增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是孔源性视网膜脱离复位手术失败的主要原因,其发病机制是视网膜表面和玻璃体后面广泛纤维增殖膜收缩、牵拉而引起视网膜脱离。纤维增殖膜主要由色素上皮细胞、胶质细胞、纤维细胞、成纤维细胞和巨噬细胞构成。色素上皮细胞在增殖性玻璃体视网膜病变的发生和发展过程中起重要作用,它不仅是增殖膜形成和收缩的主要细胞,而且可产生驱化因子,吸引纤维胶质细胞和成纤维细胞参与增殖膜的形成。增殖性玻璃体视网膜病变亦曾称为广泛玻璃体牵拉(massive vitreous retraction,MVR)、广泛视网膜前牵拉(massiv...[详细]
增生性玻璃体视网膜病变常见于过强的冷凝、电凝、外伤后、巨大视网膜裂孔、多发视网膜裂孔、长期孔源性视网膜脱离、多次眼内手术、眼外伤以及眼内炎症等。目前对发生的危险因素尚不十分肯定。但已知这些因素包括裂孔的大小和性质,玻璃体积血、炎症或手术,以及视网膜冷凝等。裂孔的性质可能是更重要的1个因素。伴有锯齿缘离断、圆形萎缩性裂孔、高度近视的黄斑小裂孔,往往不发生PVR;边缘翻卷或固定的马蹄形裂孔,很容易发生。合并玻璃体积血,有明显的玻璃体液化伴不完全性玻璃体后脱离,实行过玻璃体手术、术前脉络膜脱离或行广泛冷凝术,发生率明显增加。
PVR的基本病理生理过程是细胞增生和膜的收缩。无论从临床危险因素或是实验研究来看,都与2个发病条件有关。一是有一定数量的细胞来源;一是存在刺激细胞增生的因素。视网膜裂孔形成,尤其是大的裂孔,RPE细胞暴露面积大;细胞容易被激活,生长能力强;多种因素使血-视网膜屏障破坏,血浆因子渗出,促进细胞的游走、增生和膜形成;细胞外基质如胶原和纤维结合蛋白形成,使膜具有稳定的支架,粘连于视网膜,造成固定瘢痕,成为PVR的终末期。 PVR是孔源性视网膜脱离(rhegmatogenous retinal detachment,RRD)的常见并发症,也是造成RRD手术失败和术后视力恢复不理想的主要原因...[详细]
1.玻璃体内棕色颗粒与灰色细胞团存在,是RPE细胞释放和增生的表现,烟尘样颗粒指示细胞含有色素。RPE细胞内的黑色素颗粒,经在玻璃体内多次分裂增生后被稀释,色素减少。因此,有色素颗粒存在说明细胞尚未明显开始增生;而玻璃体内出现灰色细胞团,则是细胞增生的早期临床表现。 2.在RPE细胞开始增生时,玻璃体混浊增加,并有蛋白性条纹,提示血-眼屏障损害致血浆渗出。 3.视网膜僵硬及皱褶出现,是增生膜形成和收缩牵拉的表现。在裂孔部位,即使看不到膜,裂孔卷边或盖膜被拉向玻璃体基部,都说明膜的存在。随着病程进展,脱离的视网膜由可活动变为僵硬;增生膜在视网膜前后表面及玻璃体内形成,引起视网...[详细]
视网膜脱离是PVR最常见也是最严重的并发症。
无特殊实验室检查。
1.辅助检查 (1)眼底荧光血管造影:由于视网膜血管被纤维膜牵引,荧光血管造影可见视网膜静脉迂曲怒张,充盈延迟,黄斑周围小血管迂曲、聚拢(图3),有时可见小的荧光素渗漏点。如黄斑区广泛渗出、弥漫性或囊样水肿,则可见广泛的荧光素渗漏点,有时融合在一起呈花瓣状,有时呈大片状强荧光区。 (2)OCT:在PVR引起的黄斑病变中,OCT检查有多种不同表现:玻璃体黄斑牵引;不规则的黄斑前膜;黄斑区视网膜神经上皮水肿、增厚、囊变或脱离;有时还可见视网膜色素上皮的微皱褶。 (3)多焦视网膜电图(mERG):mERG在PVR引起的黄斑病变与其他原因引起的黄斑病变的表现无太多的差...[详细]
根据患者临床表现及眼底情况,结合B超及眼底荧光血管造影检查结果,可以确诊。
1.手术治疗 (1)手术治疗原则:①封闭所有的视网膜裂孔,是治疗孔源性视网膜脱离的基本原则,在PVR手术中仍极重要。保持视网膜附着的主要力量是RPE泵。裂孔使此泵短路,视网膜因失去对牵拉力量的对抗而脱离。因此,沿裂孔边缘凝固视网膜脉络膜能阻止液体通过裂孔流动,恢复RPE泵的功能,使视网膜复位。②对抗视网膜牵拉,包括巩膜外垫压、膜剥离、玻璃体基底部松解术、眼内气体或硅油填塞,以及松解性视网膜切开或切除术等。③减少对细胞的刺激和复发因素。首先选择能奏效且最少损伤的术式,即最小量手术原则,以减少对细胞增生的刺激。PVR C2或C3以下的视网膜脱离,应用巩膜外垫压术的视网膜复位率仍较高,应首...[详细]
出现牵拉性视网膜脱离时视力预后不良。如果牵涉致黄斑区则预后较差。视力预后的好坏在很大程度上取决于手术时机的把握。
目前没有相关内容描述。

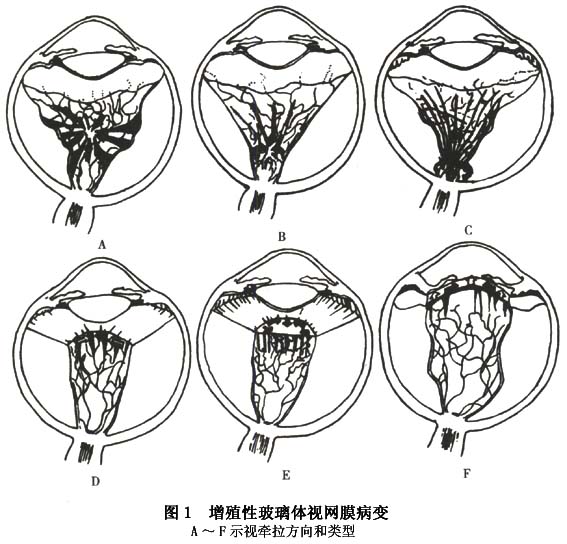
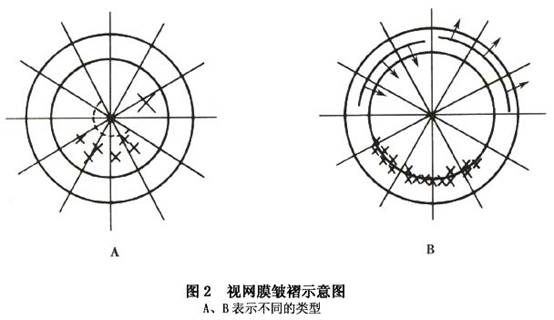 具体内容及记录法如表1和表2所示。
具体内容及记录法如表1和表2所示。

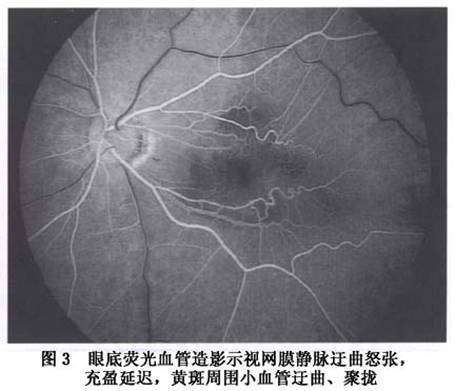 (2)OCT:在PVR引起的黄斑病变中,OCT检查有多种不同表现:玻璃体黄斑牵引;不规则的黄斑前膜;黄斑区视网膜神经上皮水肿、增厚、囊变或脱离;有时还可见视网膜色素上皮的微皱褶。 (3)多焦视网膜电图(mERG):mERG在PVR引起的黄斑病变与其他原因引起的黄斑病变的表现无太多的差别,mERG三维地形图可见黄斑区尖峰显著降低或消失(图4),或在尖峰周围呈波浪状外观;mERG曲线图可显示a波、b波振幅也明显降低(图5)。
(2)OCT:在PVR引起的黄斑病变中,OCT检查有多种不同表现:玻璃体黄斑牵引;不规则的黄斑前膜;黄斑区视网膜神经上皮水肿、增厚、囊变或脱离;有时还可见视网膜色素上皮的微皱褶。 (3)多焦视网膜电图(mERG):mERG在PVR引起的黄斑病变与其他原因引起的黄斑病变的表现无太多的差别,mERG三维地形图可见黄斑区尖峰显著降低或消失(图4),或在尖峰周围呈波浪状外观;mERG曲线图可显示a波、b波振幅也明显降低(图5)。
 2.屈光间质混浊时辅助检查及黄斑功能评价 在玻璃体重度混浊的情况下,准确判断黄斑区状况及评价黄斑功能十分困难,此时必要的检查如光感、光定位检查和B超检查尤为重要。B超检查不但能了解玻璃体纤维膜的分布及活动状况,且对后极部视网膜及黄斑区的显示更为清楚。在PVR引起的黄斑病变中,B超检查可显示后极部视网膜及黄斑区回声增强,并可发现黄斑牵引条索、黄斑前膜、有无黄斑脱离及了解玻璃体后脱离的情况。
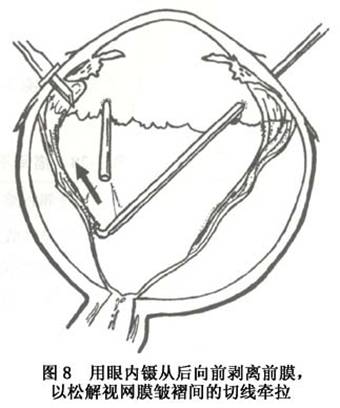
2.屈光间质混浊时辅助检查及黄斑功能评价 在玻璃体重度混浊的情况下,准确判断黄斑区状况及评价黄斑功能十分困难,此时必要的检查如光感、光定位检查和B超检查尤为重要。B超检查不但能了解玻璃体纤维膜的分布及活动状况,且对后极部视网膜及黄斑区的显示更为清楚。在PVR引起的黄斑病变中,B超检查可显示后极部视网膜及黄斑区回声增强,并可发现黄斑牵引条索、黄斑前膜、有无黄斑脱离及了解玻璃体后脱离的情况。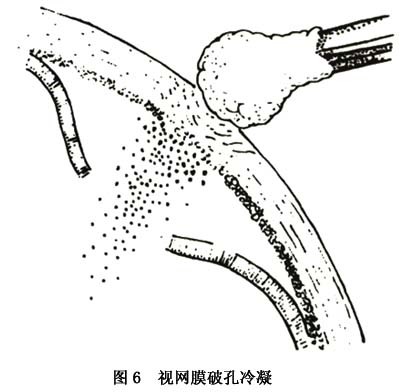 (2)影响手术预后的因素包括:①裂孔数目、大小和位置:裂孔与视网膜前膜的位置与裂孔封闭有关。②玻璃体基底部的收缩程度和增生膜的前后位置:PVR多有玻璃体基底部的细胞收缩。此处粘连很紧,不易完全切除,有时可能需要外垫压支持残余的牵拉。有时玻璃体基部的收缩非常严重,需要做大的视网膜切开术。往往预后很差。③赤道后视网膜前膜的严重程度,主要取决于术中能否切除。④视网膜后膜的严重程度与位置:在视盘周围会造成“餐巾环”,须广泛切开才能松解牵拉。⑤以往手术的次数:越多越差。 (3)一些技术要点:①放射形外垫压可有效地封闭视网膜裂孔,应用褥式缝线(比硅胶海绵垫宽3mm) 固定,效果可靠。②对只用巩膜外垫压不能封闭裂孔、或牵拉性脱离起主要作用,需作玻璃体切割术。首先切割中央部的玻璃体或无晶状体眼的前玻璃体层,然后是周边部,在没有松解后部牵拉前,由于后部的张力存在,切除周边部玻璃体较容易,此时由助手顶压巩膜,逐一暴露各个象限进行切除(图7)。对玻璃体基底部常有的致密纤维组织,可用眼内剪切断,再用切割头把剩下的玻璃体切除。此后,从后向前分离视网膜前膜,由于后部视网膜较厚,不易造成医源性裂孔,再以眼内镊从后向前剥离前膜,以松解视网膜皱褶间的切线牵拉(图8)。厚而宽的膜一般容易剥除,如不能整片去掉,可把膜剪碎取出。只对阻止复位的视网膜后膜作切除术。术中先在后膜部位作视网膜切开,此时后膜会自动退缩,如不退缩,可用镊子抓着取出。③采用眼内气体填塞:可借气体的表面张力顶压视网膜裂孔。常用的气体有六氟化硫及全氟丙烷。气液交换前要松解所有的牵拉,否则残留的牵拉会形成新的裂孔,或使原有的裂孔扩大。有时需要先扎紧外垫压,再作气液交换。
(2)影响手术预后的因素包括:①裂孔数目、大小和位置:裂孔与视网膜前膜的位置与裂孔封闭有关。②玻璃体基底部的收缩程度和增生膜的前后位置:PVR多有玻璃体基底部的细胞收缩。此处粘连很紧,不易完全切除,有时可能需要外垫压支持残余的牵拉。有时玻璃体基部的收缩非常严重,需要做大的视网膜切开术。往往预后很差。③赤道后视网膜前膜的严重程度,主要取决于术中能否切除。④视网膜后膜的严重程度与位置:在视盘周围会造成“餐巾环”,须广泛切开才能松解牵拉。⑤以往手术的次数:越多越差。 (3)一些技术要点:①放射形外垫压可有效地封闭视网膜裂孔,应用褥式缝线(比硅胶海绵垫宽3mm) 固定,效果可靠。②对只用巩膜外垫压不能封闭裂孔、或牵拉性脱离起主要作用,需作玻璃体切割术。首先切割中央部的玻璃体或无晶状体眼的前玻璃体层,然后是周边部,在没有松解后部牵拉前,由于后部的张力存在,切除周边部玻璃体较容易,此时由助手顶压巩膜,逐一暴露各个象限进行切除(图7)。对玻璃体基底部常有的致密纤维组织,可用眼内剪切断,再用切割头把剩下的玻璃体切除。此后,从后向前分离视网膜前膜,由于后部视网膜较厚,不易造成医源性裂孔,再以眼内镊从后向前剥离前膜,以松解视网膜皱褶间的切线牵拉(图8)。厚而宽的膜一般容易剥除,如不能整片去掉,可把膜剪碎取出。只对阻止复位的视网膜后膜作切除术。术中先在后膜部位作视网膜切开,此时后膜会自动退缩,如不退缩,可用镊子抓着取出。③采用眼内气体填塞:可借气体的表面张力顶压视网膜裂孔。常用的气体有六氟化硫及全氟丙烷。气液交换前要松解所有的牵拉,否则残留的牵拉会形成新的裂孔,或使原有的裂孔扩大。有时需要先扎紧外垫压,再作气液交换。
 2.药物疗法 尽管采用了许多手术方法促使PVR的视网膜复位,但仍有一些病例手术后复发。其主要原因是视网膜表面的细胞增生。因此药物疗法的研究是非常必要的。由于PVR是由细胞增生和收缩引起的病变,抑制细胞增生是药物治疗的关键。一些药物曾在实验和临床上应用。如秋水仙碱是一种抑制有丝分裂的药物,在实验中有抑制细胞增生的作用。一些抗代谢药物也可能使用,如5-氟尿苷和道诺霉素在临床的应用已取得一定结果,国内应用高山尖杉酯碱对实验性牵拉性视网膜脱离也有一定疗效,但对眼的毒性是一个主要问题。使用微泵、巩膜导管或药物缓慢释放药物,以维持较长的局部药物浓度的实验也见于报道。近年很多研究集中在相关的细胞因子及其调节,但由于细胞的生长和死亡由复杂的信号网络控制,针对单一因子不太可能奏效。 糖皮质激素类是一种有希望治疗PVR的药物。大剂量时能抑制有丝分裂,而且对眼的组织无明显毒性。将缓慢溶解的糖皮质激素注入玻璃体可提供长效的治疗剂量,而没有全身的副作用。已试用酒精地塞米松及醋酸曲安奈德 (后者为结晶状体),以较大剂量(1~2mg)注入玻璃体,可长期存在(在正常兔眼7周,玻璃体切割术后的眼2周),对成纤维细胞有明显的抑制作用,发生于实验性视网膜脱离的眼明显减少,电生理和超微结构检查未发现毒性反应。由于糖皮质激素也具有强大的抗炎作用,而炎症反应的细胞和体液因子在细胞的游走和增生中起重要作用,因此糖皮质激素治疗PVR的作用也可能部分地通过抗炎而实现,早期全身或局部应用可能有预防作用。
2.药物疗法 尽管采用了许多手术方法促使PVR的视网膜复位,但仍有一些病例手术后复发。其主要原因是视网膜表面的细胞增生。因此药物疗法的研究是非常必要的。由于PVR是由细胞增生和收缩引起的病变,抑制细胞增生是药物治疗的关键。一些药物曾在实验和临床上应用。如秋水仙碱是一种抑制有丝分裂的药物,在实验中有抑制细胞增生的作用。一些抗代谢药物也可能使用,如5-氟尿苷和道诺霉素在临床的应用已取得一定结果,国内应用高山尖杉酯碱对实验性牵拉性视网膜脱离也有一定疗效,但对眼的毒性是一个主要问题。使用微泵、巩膜导管或药物缓慢释放药物,以维持较长的局部药物浓度的实验也见于报道。近年很多研究集中在相关的细胞因子及其调节,但由于细胞的生长和死亡由复杂的信号网络控制,针对单一因子不太可能奏效。 糖皮质激素类是一种有希望治疗PVR的药物。大剂量时能抑制有丝分裂,而且对眼的组织无明显毒性。将缓慢溶解的糖皮质激素注入玻璃体可提供长效的治疗剂量,而没有全身的副作用。已试用酒精地塞米松及醋酸曲安奈德 (后者为结晶状体),以较大剂量(1~2mg)注入玻璃体,可长期存在(在正常兔眼7周,玻璃体切割术后的眼2周),对成纤维细胞有明显的抑制作用,发生于实验性视网膜脱离的眼明显减少,电生理和超微结构检查未发现毒性反应。由于糖皮质激素也具有强大的抗炎作用,而炎症反应的细胞和体液因子在细胞的游走和增生中起重要作用,因此糖皮质激素治疗PVR的作用也可能部分地通过抗炎而实现,早期全身或局部应用可能有预防作用。 浙公网安备
33010902000463号
浙公网安备
33010902000463号