视网膜静脉阻塞(retinal vein occlusion)是比较常见的眼底血管病。分支静脉阻塞于1877年首先由Leber描述,而视网膜中央静脉阻塞则于1878年由von Michele命名。本病特点是静脉扩张迂曲,沿静脉分布区域的视网膜有出血、水肿和渗出。随着电镜、激光和眼底照相等技术的发展,对本病的病因、分类、并发症、预后和治疗有进一步的认识和提高,虽然目前治疗效果尚不理想。
视网膜静脉阻塞的病因比较复杂,为多因素致病。与高血压、动脉硬化、血液高黏度和血流动力学异常等有密切关系。外伤、口服避孕药或过度疲劳等均可为发病的诱因。总之,视网膜静脉阻塞常为多因素致病,既有血管异常也有血液成分的改变或血流动力学异常的因素。
1.血管壁的改变 视网膜动脉硬化在视网膜静脉阻塞发病中占重要地位,有80%~95%的病人同时有动脉硬化。最常发生阻塞的部位在筛板区和动静脉交叉处。在这2个部位,视网膜中央动脉和静脉靠得很近,相邻血管壁共有一外膜,被同一结缔组织膜包裹。动脉硬化时,受硬化外膜的限制,静脉受压管腔变窄,且管壁内皮细胞受刺激增生,管腔变得更窄,血流变慢,甚至停滞,导致血小板、红细胞和纤维蛋白原沉积而形成血栓。当同时有高血压、糖尿病或血液病时更易加重这种变化。 另一方面,视网膜静脉本身的炎症或炎症产生的毒素也可使静脉管壁增厚,内膜受损,内皮细胞增生,表面电荷发生改变,以致血小板聚集,纤维蛋白原网络血液细胞成...[详细]
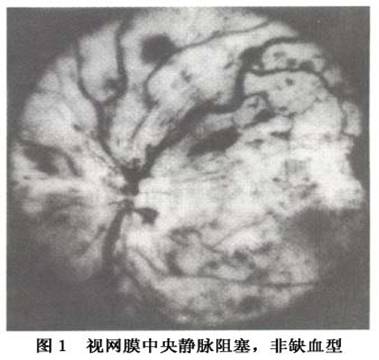
1.视网膜中央静脉阻塞(central retinal vein occlusion) 分为2种类型: (1)轻型:又称非缺血型(nonischemic)、高渗透型(hyperpermeable)或部分性(partial)阻塞。自觉症状轻微或全无症状,根据黄斑受损的程度,视力可以正常或轻度减退,视野正常或有轻度改变。眼底检查:早期:视盘正常或边界轻度模糊、水肿。黄斑区正常或有轻度水肿、出血。动脉管径正常,静脉迂曲扩张,沿着视网膜4支静脉有少量或中等量火焰状和点状出血,没有或偶见棉絮状斑,视网膜有轻度水肿。荧光血管造影视网膜循环时间正常或稍延长,静脉管壁轻度荧光素渗漏,毛细血管轻度扩...[详细]
视网膜静脉阻塞的并发症和后遗症较多,总的来说可概括为两大类:第1类为黄斑部的并发症和后遗症,包括黄斑囊样水肿、黄斑前膜形成、黄斑瘢痕形成等。第2类为新生血管及其并发症,包括新生血管性青光眼、玻璃体积血、增殖、机化膜形成、牵拉视网膜形成破孔和视网膜脱离。在以上并发症中以黄斑囊样水肿和新生血管最为常见。 1.黄斑囊样水肿 是视网膜静脉阻塞最常见的并发症,也是本病视力降低的主要原因之一。其发病率总干略高于分支阻塞。总干阻塞囊样水肿的发病率为40%~66%,分支阻塞者为30%~62%。黄斑囊样水肿发生的时间根据病情轻重而有不同,病情严重者发生较早,可在静脉阻塞后1个月发生,有的在发病后数月...[详细]
血液流变学检查可了解血浆黏度和全血黏度,可进行β凝血蛋白和血小板第Ⅳ因子含量测定。
FFA荧光造影所见亦因阻塞部位(总干、半侧、分支)、阻塞程度(完全性、不完全性)及病程之早晚而有所不同。 总干完全性阻塞在病程之初,造影早期因视网膜有大量出血病灶,使脉络膜及视网膜荧光被遮蔽。在未被遮蔽处则可见迟缓充盈的动、静脉(动-静脉过渡时间延长,往往超过20s);造影后期,静脉管壁及其附近组织染色而呈弥漫性强荧光。当荧光素到达黄斑周围毛细血管时,如该处未被出血遮盖,便有明显荧光素渗漏,并逐渐进入并潴留于微小的囊样间隙中。病程晚期,由于视网膜内层毛细血管床缺血而出现无灌注区。无灌注区周围残存毛细血管呈瘤状扩张。各种异常径路的侧支循环及新生血管在眼底任何部位均可出现,但在视盘面最多...[详细]
根据典型的眼底改变,同时结合FFA检查结果及临床表现可以确定诊断。
本病治疗比较困难,对某些疗法也存在争论。从理论上讲,血栓形成应用抗凝剂治疗,但实际上效果并不理想,许多过去使用的抗凝药已不再应用。迄今尚无特殊有效的治疗。一般可针对病因治疗和防治血栓形成,如降低血压和眼压,降低血液黏度,减轻血栓形成和组织水肿,并促进出血吸收。 1.纤溶制剂使纤维蛋白溶解,减轻或去除血栓形成。包括尿激酶、链激酶、去纤酶和组织纤溶酶原激活剂(tissue plasminogen activator,t-PA)等。治疗前应检查纤维蛋白原及凝血酶原时间,低于正常者不宜应用。 (1)尿激酶:使纤溶酶原转变为纤溶酶。纤溶酶具有强烈的水解纤维蛋白的作用,可有溶解血栓的效...[详细]
视网膜静脉阻塞的预后与阻塞的类型、阻塞部位、阻塞程度和发生的并发症等有关。一般说来,总干阻塞比分支阻塞预后差,缺血型比非缺血型者差。国内有人报告本病944只眼,致盲率为16.9%,其中总干阻塞致盲者占27.6%,半侧阻塞占11.7%,分支阻塞占8.6%。总干阻塞无论用纤溶制剂或光凝疗法均不能使视力改善,仅能预防新生血管的产生。分支阻塞预后较好,未经治疗的分支阻塞,视力恢复在0.5以上者为60%和53%。影响视力预后的主要原因为黄斑囊样水肿和新生血管及其并发症——玻璃体积血和新生血管性青光眼。
注意及时处理全身性血液及血管性疾病。

 (2)重型:又称缺血型(ischemic)、出血型(hemorrhagic)或完全型(complete)阻塞。 ①早期:大多数病人有视物模糊、视力明显减退,严重者视力降至手动,合并动脉阻塞者可降至仅有光感。可有浓密中心暗点的视野缺损或周边缩窄。眼底检查可见视盘高度水肿充血,边界模糊并可被出血掩盖。黄斑区可有明显水肿隆起和出血,可呈弥漫水肿或呈囊样水肿。黄斑囊样水肿为小泡状,排列成花瓣形或呈蜂房样。还可有出血位于囊内,形成半月形或半圆形液平面。动脉管径正常或变细,静脉高度扩张迂曲如腊肠状,或呈环状起伏于水肿的视网膜中,由于缺氧,静脉血柱呈暗红色,严重者由于血流停滞,红细胞聚集在血管内,呈现颗粒状血流。视网膜严重水肿尤以后极部明显。大量片状点状出血,沿静脉分布,严重者遍布整个眼底。从表浅层毛细血管层渗出的出血呈火焰状,从深层血管层渗出的出血为点状或斑状。严重者围绕视盘形成大片花瓣状出血,甚至进入内界膜下造成舟状视网膜前出血,更重者穿破内界膜成为玻璃体积血。视网膜常有棉絮状斑,随病情加重而增多(图2)。这种棉絮状斑是由于急性前毛细血管小动脉闭塞抑制了神经纤维层的轴浆运输而形成。视网膜电图b波降低或熄灭,暗适应功能降低。荧光血管造影视网膜循环时间延长,偶有臂-视网膜循环时间延长,视盘毛细血管扩张,荧光素渗漏超过视盘边界。由于大片出血掩盖了毛细血管床形成无荧光区,从缝隙中可看到静脉管壁有大量荧光素渗漏。毛细血管高度迂曲扩张,形成多量微血管瘤。黄斑有点状或弥漫荧光素渗漏,如有囊样水肿则形成花瓣状或蜂窝状荧光素渗漏。
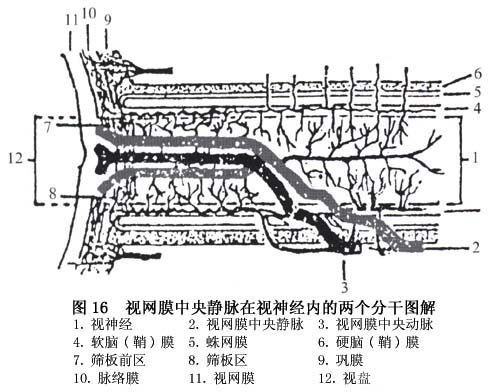
(2)重型:又称缺血型(ischemic)、出血型(hemorrhagic)或完全型(complete)阻塞。 ①早期:大多数病人有视物模糊、视力明显减退,严重者视力降至手动,合并动脉阻塞者可降至仅有光感。可有浓密中心暗点的视野缺损或周边缩窄。眼底检查可见视盘高度水肿充血,边界模糊并可被出血掩盖。黄斑区可有明显水肿隆起和出血,可呈弥漫水肿或呈囊样水肿。黄斑囊样水肿为小泡状,排列成花瓣形或呈蜂房样。还可有出血位于囊内,形成半月形或半圆形液平面。动脉管径正常或变细,静脉高度扩张迂曲如腊肠状,或呈环状起伏于水肿的视网膜中,由于缺氧,静脉血柱呈暗红色,严重者由于血流停滞,红细胞聚集在血管内,呈现颗粒状血流。视网膜严重水肿尤以后极部明显。大量片状点状出血,沿静脉分布,严重者遍布整个眼底。从表浅层毛细血管层渗出的出血呈火焰状,从深层血管层渗出的出血为点状或斑状。严重者围绕视盘形成大片花瓣状出血,甚至进入内界膜下造成舟状视网膜前出血,更重者穿破内界膜成为玻璃体积血。视网膜常有棉絮状斑,随病情加重而增多(图2)。这种棉絮状斑是由于急性前毛细血管小动脉闭塞抑制了神经纤维层的轴浆运输而形成。视网膜电图b波降低或熄灭,暗适应功能降低。荧光血管造影视网膜循环时间延长,偶有臂-视网膜循环时间延长,视盘毛细血管扩张,荧光素渗漏超过视盘边界。由于大片出血掩盖了毛细血管床形成无荧光区,从缝隙中可看到静脉管壁有大量荧光素渗漏。毛细血管高度迂曲扩张,形成多量微血管瘤。黄斑有点状或弥漫荧光素渗漏,如有囊样水肿则形成花瓣状或蜂窝状荧光素渗漏。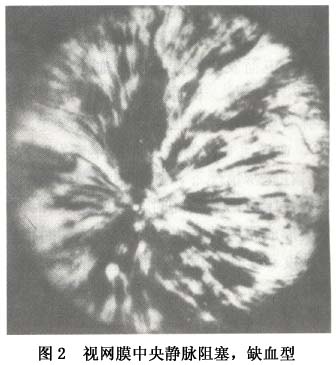 ②晚期:一般在发病6~12个月后进入晚期,视盘水肿消退,颜色恢复正常或变淡,其表面或边缘常有睫状视网膜侧支血管形成,呈环状或螺旋状,比较粗大;或有新生血管形成,呈卷丝状或花环状,比较细窄,有的可突入玻璃体内,在眼底飘浮。黄斑水肿消退,有色素紊乱,或花瓣状暗红色斑,提示以往曾有黄斑囊样水肿。严重者视网膜胶质增生,成纤维细胞聚集形成继发性视网膜前膜,或掺杂有色素的瘢痕形成,视力严重受损。动脉管径大多数变细并有白鞘,有的完全闭塞呈银丝状。静脉管径不规则,也有的变窄有白鞘伴随,特别是炎症所致者更明显。视网膜出血和棉絮状斑吸收,或留有硬性渗出,吸收较慢,一般在1年或数年内完全吸收。毛细血管闭塞,甚至小动脉和小静脉也闭塞,形成大片无灌注区。有的视盘和视网膜有新生血管形成,可导致玻璃体积血、纤维增殖、牵拉性视网膜脱离,有的可发生新生血管性青光眼。荧光血管造影可见视盘有粗大侧支或新生血管,后者有大量荧光素渗漏。黄斑可正常或残留点状渗漏或花瓣状渗漏,或表现为点状或片状透见荧光。动脉管径变细,静脉管壁基本不渗漏或有局限性渗漏。毛细血管闭塞形成大片无灌注区,从视网膜周边部开始,呈岛状,以后进行可连成片状,重者可进行至赤道部甚至视盘周围。无灌注区附近常有动静脉短路、微血管瘤和(或)新生血管形成。本病眼压早期正常、晚期如合并新生血管性青光眼则可急剧升高。 2.半侧性视网膜静脉阻塞(hemi-central retinal vein occlusion) 在视网膜血管发育过程中,玻璃体动脉经过胚裂进入视杯,至胚胎3个月时,动脉两侧出现2支静脉进入视神经,正常人在视盘之后的视神经内彼此汇合形成视网膜中央静脉。通常在出生后其中一支消失,留下1支主干。然而某些人可遗留下来,形成2支静脉主干。半侧性阻塞即是其中一支主干在筛板处或视神经内形成阻塞。这一型阻塞在临床上比较少见,发病率6%~13%。通常1/2视网膜受累(图3)。偶可见1/3或2/3视网膜受累。其临床表现、病程和预后与视网膜中央静脉阻塞类似。如有大片无灌注区,也可产生新生血管性青光眼。
②晚期:一般在发病6~12个月后进入晚期,视盘水肿消退,颜色恢复正常或变淡,其表面或边缘常有睫状视网膜侧支血管形成,呈环状或螺旋状,比较粗大;或有新生血管形成,呈卷丝状或花环状,比较细窄,有的可突入玻璃体内,在眼底飘浮。黄斑水肿消退,有色素紊乱,或花瓣状暗红色斑,提示以往曾有黄斑囊样水肿。严重者视网膜胶质增生,成纤维细胞聚集形成继发性视网膜前膜,或掺杂有色素的瘢痕形成,视力严重受损。动脉管径大多数变细并有白鞘,有的完全闭塞呈银丝状。静脉管径不规则,也有的变窄有白鞘伴随,特别是炎症所致者更明显。视网膜出血和棉絮状斑吸收,或留有硬性渗出,吸收较慢,一般在1年或数年内完全吸收。毛细血管闭塞,甚至小动脉和小静脉也闭塞,形成大片无灌注区。有的视盘和视网膜有新生血管形成,可导致玻璃体积血、纤维增殖、牵拉性视网膜脱离,有的可发生新生血管性青光眼。荧光血管造影可见视盘有粗大侧支或新生血管,后者有大量荧光素渗漏。黄斑可正常或残留点状渗漏或花瓣状渗漏,或表现为点状或片状透见荧光。动脉管径变细,静脉管壁基本不渗漏或有局限性渗漏。毛细血管闭塞形成大片无灌注区,从视网膜周边部开始,呈岛状,以后进行可连成片状,重者可进行至赤道部甚至视盘周围。无灌注区附近常有动静脉短路、微血管瘤和(或)新生血管形成。本病眼压早期正常、晚期如合并新生血管性青光眼则可急剧升高。 2.半侧性视网膜静脉阻塞(hemi-central retinal vein occlusion) 在视网膜血管发育过程中,玻璃体动脉经过胚裂进入视杯,至胚胎3个月时,动脉两侧出现2支静脉进入视神经,正常人在视盘之后的视神经内彼此汇合形成视网膜中央静脉。通常在出生后其中一支消失,留下1支主干。然而某些人可遗留下来,形成2支静脉主干。半侧性阻塞即是其中一支主干在筛板处或视神经内形成阻塞。这一型阻塞在临床上比较少见,发病率6%~13%。通常1/2视网膜受累(图3)。偶可见1/3或2/3视网膜受累。其临床表现、病程和预后与视网膜中央静脉阻塞类似。如有大片无灌注区,也可产生新生血管性青光眼。 3.视网膜分支静脉阻塞(branch retinal vein occlusion) 分支静脉阻塞以颞侧支最常受累,占90%~93%,其中又以颞上支阻塞最多见,占62%~72%,鼻侧支阻塞极少,发病率在1.5%~3.0%。黄斑小分支阻塞比主干分支阻塞预后好,因为黄斑小分支引流的范围小且该处毛细血管层厚,产生无灌注区的可能性小,即使产生面积也很小,故引起晚期并发症新生血管的可能性小。与此相反,主干阻塞则并发症较多。 (1)早期:视力减退的状况根据压迫点位于静脉主干或小分支而有不同。阻塞位于主干和黄斑分支者,视力有不同程度减退,不供应黄斑的分支阻塞,视力可不受影响,视野有与视网膜受损区域相对应的改变。眼底检查视网膜动脉常变细有硬化改变。阻塞点在动静脉交叉处,该处静脉常位于动脉之下、受硬化动脉的压迫管径变细呈笔尖状,甚至看不见静脉血流,若静脉位于动脉之上则在动脉表面走行如过桥状,管径也变窄或不规则。有时可见血管阻塞点处有白色纤维组织增生如细纱状或薄膜状,动静脉被包裹在薄膜内,但静脉受压管径变细,甚至不能辨认。阻塞点远端静脉迂曲扩张如腊肠状,沿静脉呈现扇形分布的视网膜浅层和深层出血,重者也可有视网膜前出血或玻璃体积血。视网膜水肿增厚,可见棉絮状斑。如侵犯黄斑则黄斑区水肿隆起,并可为出血掩盖,还可产生黄斑囊样水肿。视盘及其他处视网膜正常。荧光血管造影能查见受累静脉迟缓充盈,阻塞点处静脉呈笔尖状或完全压断,无荧光血流通过。造影晚期阻塞点静脉可呈现强荧光点,表示血管内皮细胞受损,阻塞点远端静脉扩张,管壁有荧光素渗漏。毛细血管迂曲扩张形成微血管瘤,伴有渗漏。视网膜出血多者可掩盖荧光。黄斑拱环可部分断裂,有点状荧光素渗漏。如有黄斑囊样水肿则形成不完全花瓣状强荧光。 (2)晚期:通常约在发病6个月以后出血逐渐吸收,水肿消退,视盘黄斑区出现星状或不规则形点状硬性渗出或黄斑颞侧有环状渗出,这种渗出吸收较慢。黄斑水肿消退,留下色素紊乱或囊样变性瘢痕。伴行动脉产生继发性硬化,管径变窄有白鞘伴随。偶见小动脉闭塞呈银丝状。受累静脉管径恢复或粗细不均,在阻塞处血流完全恢复,也可部分恢复,或完全闭塞呈银丝状。静脉管壁有白鞘,小静脉可闭塞。阻塞点附近和视网膜水平缝处可见侧支形成。有大片毛细血管闭塞者,可发生视盘和视网膜新生血管,1年或数年后可突然发生玻璃体积血。荧光血管造影见受累静脉荧光充盈正常或仍有延迟。管壁一般无渗漏或偶有局限渗漏。阻塞处静脉变细或完全无荧光素通过,其附近和水平缝处常有侧支血管形成。侧支形成途径有二,即阻塞支与邻近未阻塞静脉形成侧支,或阻塞静脉本身在阻塞段与非阻塞段形成侧支。严重主干阻塞可有大片无灌注区,从周边部向后一直延伸至赤道部,甚至后极部。这种病例常常在视盘和(或)无灌注区的边缘有新生血管,呈卷丝状、花圈状或海团扇状,晚期有大量荧光素渗漏。在无灌注区附近常有动静脉短路(图4)。
3.视网膜分支静脉阻塞(branch retinal vein occlusion) 分支静脉阻塞以颞侧支最常受累,占90%~93%,其中又以颞上支阻塞最多见,占62%~72%,鼻侧支阻塞极少,发病率在1.5%~3.0%。黄斑小分支阻塞比主干分支阻塞预后好,因为黄斑小分支引流的范围小且该处毛细血管层厚,产生无灌注区的可能性小,即使产生面积也很小,故引起晚期并发症新生血管的可能性小。与此相反,主干阻塞则并发症较多。 (1)早期:视力减退的状况根据压迫点位于静脉主干或小分支而有不同。阻塞位于主干和黄斑分支者,视力有不同程度减退,不供应黄斑的分支阻塞,视力可不受影响,视野有与视网膜受损区域相对应的改变。眼底检查视网膜动脉常变细有硬化改变。阻塞点在动静脉交叉处,该处静脉常位于动脉之下、受硬化动脉的压迫管径变细呈笔尖状,甚至看不见静脉血流,若静脉位于动脉之上则在动脉表面走行如过桥状,管径也变窄或不规则。有时可见血管阻塞点处有白色纤维组织增生如细纱状或薄膜状,动静脉被包裹在薄膜内,但静脉受压管径变细,甚至不能辨认。阻塞点远端静脉迂曲扩张如腊肠状,沿静脉呈现扇形分布的视网膜浅层和深层出血,重者也可有视网膜前出血或玻璃体积血。视网膜水肿增厚,可见棉絮状斑。如侵犯黄斑则黄斑区水肿隆起,并可为出血掩盖,还可产生黄斑囊样水肿。视盘及其他处视网膜正常。荧光血管造影能查见受累静脉迟缓充盈,阻塞点处静脉呈笔尖状或完全压断,无荧光血流通过。造影晚期阻塞点静脉可呈现强荧光点,表示血管内皮细胞受损,阻塞点远端静脉扩张,管壁有荧光素渗漏。毛细血管迂曲扩张形成微血管瘤,伴有渗漏。视网膜出血多者可掩盖荧光。黄斑拱环可部分断裂,有点状荧光素渗漏。如有黄斑囊样水肿则形成不完全花瓣状强荧光。 (2)晚期:通常约在发病6个月以后出血逐渐吸收,水肿消退,视盘黄斑区出现星状或不规则形点状硬性渗出或黄斑颞侧有环状渗出,这种渗出吸收较慢。黄斑水肿消退,留下色素紊乱或囊样变性瘢痕。伴行动脉产生继发性硬化,管径变窄有白鞘伴随。偶见小动脉闭塞呈银丝状。受累静脉管径恢复或粗细不均,在阻塞处血流完全恢复,也可部分恢复,或完全闭塞呈银丝状。静脉管壁有白鞘,小静脉可闭塞。阻塞点附近和视网膜水平缝处可见侧支形成。有大片毛细血管闭塞者,可发生视盘和视网膜新生血管,1年或数年后可突然发生玻璃体积血。荧光血管造影见受累静脉荧光充盈正常或仍有延迟。管壁一般无渗漏或偶有局限渗漏。阻塞处静脉变细或完全无荧光素通过,其附近和水平缝处常有侧支血管形成。侧支形成途径有二,即阻塞支与邻近未阻塞静脉形成侧支,或阻塞静脉本身在阻塞段与非阻塞段形成侧支。严重主干阻塞可有大片无灌注区,从周边部向后一直延伸至赤道部,甚至后极部。这种病例常常在视盘和(或)无灌注区的边缘有新生血管,呈卷丝状、花圈状或海团扇状,晚期有大量荧光素渗漏。在无灌注区附近常有动静脉短路(图4)。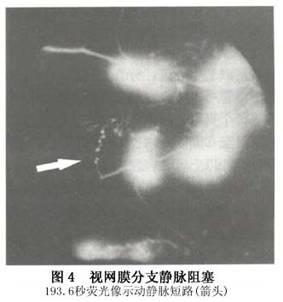
 2.新生血管和新生血管性青光眼 新生血管是视网膜静脉阻塞最常见的并发症之一,常导致玻璃体反复出血而视力严重受损。新生血管产生的时间最早者为发病后3个月,随病程延长发病率增高。新生血管发生在视网膜和视盘上,总干阻塞产生的新生血管一般比分支阻塞者少,这是由于总干缺血型阻塞还未产生较多视网膜新生血管时已发生了新生血管性青光眼。新生血管发生在视网膜上者总干阻塞为7.7%,分支阻塞为24.1%,半侧阻塞为41.9%。新生血管位于视盘者,总干为5.1%,分支为11.5%,半侧为29%。新生血管常发生在无灌注区的边缘,或远离缺血区的视盘上或视盘附近的视网膜上。其形态最初呈芽孢状,逐渐长大呈丝网状、花圈状或海团扇状(图6)。荧光血管造影有大量荧光素渗漏。新生血管与视网膜无灌注的范围大小有密切关系,无灌注区超过5~7PD范围者则可产生新生血管。无灌注区面积愈大,产生新生血管的可能性愈大。
2.新生血管和新生血管性青光眼 新生血管是视网膜静脉阻塞最常见的并发症之一,常导致玻璃体反复出血而视力严重受损。新生血管产生的时间最早者为发病后3个月,随病程延长发病率增高。新生血管发生在视网膜和视盘上,总干阻塞产生的新生血管一般比分支阻塞者少,这是由于总干缺血型阻塞还未产生较多视网膜新生血管时已发生了新生血管性青光眼。新生血管发生在视网膜上者总干阻塞为7.7%,分支阻塞为24.1%,半侧阻塞为41.9%。新生血管位于视盘者,总干为5.1%,分支为11.5%,半侧为29%。新生血管常发生在无灌注区的边缘,或远离缺血区的视盘上或视盘附近的视网膜上。其形态最初呈芽孢状,逐渐长大呈丝网状、花圈状或海团扇状(图6)。荧光血管造影有大量荧光素渗漏。新生血管与视网膜无灌注的范围大小有密切关系,无灌注区超过5~7PD范围者则可产生新生血管。无灌注区面积愈大,产生新生血管的可能性愈大。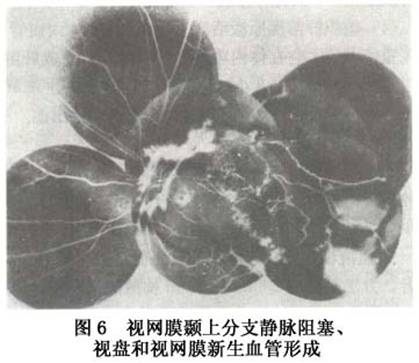 新生血管性青光眼是本病最严重的并发症。其发病率各作者报告差异比较大,以1974年以来报告的资料为4%~29%,一般在20%左右。有人报道总干阻塞发生青光眼者为33.3%,半侧阻塞为3.2%,分支阻塞不会发生新生血管性青光眼;新生血管性青光眼通常发生在总干阻塞缺血型患眼,一般在阻塞后2~3个月发病,故以往又称为“百日青光眼”,也有报告2周或数年后发病者。其特点是首先在虹膜出现新生血管,逐渐扩展至前房脚,新生血管长入小梁网,堵塞房角导致虹膜周边前粘连,房角关闭,眼压升高而有头痛眼胀等症状。球结膜血管扩张充血,角膜水肿,虹膜瞳孔缘色素上皮外翻,瞳孔扩大。早期当角膜尚未发生水肿时,荧光造影可显示视网膜周边部至后极部毛细血管完全闭塞,甚至大的动脉和静脉也完全闭塞,仅有视盘及其附近的大血管和新生血管荧光充盈。一旦产生这种并发症,预后极差,药物和手术均难奏效,大多数患者视力完全丧失。
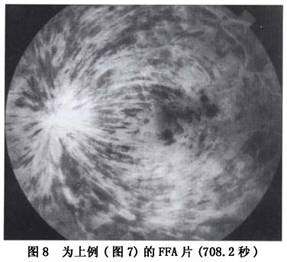
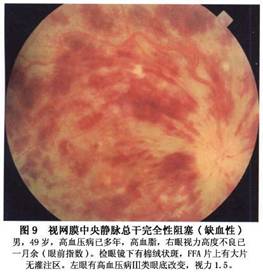
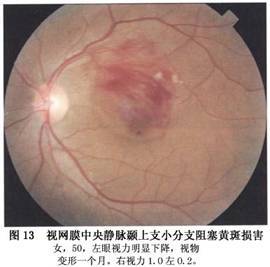
新生血管性青光眼是本病最严重的并发症。其发病率各作者报告差异比较大,以1974年以来报告的资料为4%~29%,一般在20%左右。有人报道总干阻塞发生青光眼者为33.3%,半侧阻塞为3.2%,分支阻塞不会发生新生血管性青光眼;新生血管性青光眼通常发生在总干阻塞缺血型患眼,一般在阻塞后2~3个月发病,故以往又称为“百日青光眼”,也有报告2周或数年后发病者。其特点是首先在虹膜出现新生血管,逐渐扩展至前房脚,新生血管长入小梁网,堵塞房角导致虹膜周边前粘连,房角关闭,眼压升高而有头痛眼胀等症状。球结膜血管扩张充血,角膜水肿,虹膜瞳孔缘色素上皮外翻,瞳孔扩大。早期当角膜尚未发生水肿时,荧光造影可显示视网膜周边部至后极部毛细血管完全闭塞,甚至大的动脉和静脉也完全闭塞,仅有视盘及其附近的大血管和新生血管荧光充盈。一旦产生这种并发症,预后极差,药物和手术均难奏效,大多数患者视力完全丧失。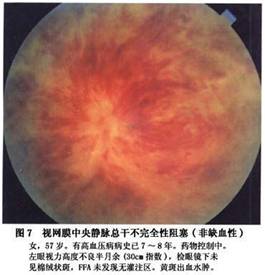




 浙公网安备
33010902000463号
浙公网安备
33010902000463号