-
科室:
血液科
-
别名:
消耗性凝血病
去纤维蛋白原综合征
弥漫性血管内凝血
-
症状:
贫血
出血
-
发病部位:
暂无
-
多发人群:
严重疾病基础继发
-
相关疾病:
暂无
播散性血管内凝血(disseminated intravascular coagulation,DIC)是一种发生在许多严重疾病基础上或某些特殊条件下由致病因素激活人体凝血系统,导致微循环弥散性微血栓形成及继发性纤溶亢进的综合征。由于DIC发展过程中多有不同程度凝血因子水平消耗性下降,故有些学者称之为“消耗性凝血病”(consumption coagulopathy)。鉴于绝大多数DIC患者有血浆纤维蛋白原水平的下降,故有些学者称之为“去纤维蛋白原综合征”。 弥散性血管内凝血(DIC)不是一个独立的疾病,而是继发于不同疾病的临床病理综合征。其基本特征是由于病理性凝血酶和纤溶酶的大量生成,导致广泛的微血栓形成、出血及脏器功能不全。DIC的病因很多,发病机制也往往是多种机制的组合。在我国,诱发DIC的最常见病因是感染性疾病,其次为产科意外、肿瘤性疾病、外伤等。无论何种病因引起的DIC,凝血酶和纤溶酶的过度生成为其共同特征。DIC的临床和实验室表现反映着凝血酶和纤溶酶的综合作用,治疗以去除原发病因最为重要,其他方法包括补充凝血成分、抗凝和抗纤溶等。[收起]
播散性血管内凝血(disseminated intravascular coagulation,DIC)是一种发生在许多严重疾病基础上或某些特殊条件下由致病因素激活人体凝血系统,导致微循环弥散性微血栓形成及继发性纤溶亢进的综合征。由于DIC发展过程中多有不同程度凝血因子水平消耗性下降,故有些学者称之为“消耗性凝血病”(consumption coagulopathy)。鉴于绝大多数DIC患者有血浆纤维蛋白原水平的下降,故有些学者称之为“去纤维蛋白原综合征”。 弥散性血管内凝血(DIC)不是一个独立的疾病,而是继发于不同疾病的临床病理综合征。其基本特征是由于病理性凝血酶和纤溶酶的大量生...[详细]
临床各科多种疾病均可导致DIC。常见者为感染、肿瘤、病理产科、手术及创伤。 1.感染性疾病 由感染所诱发的DIC占总发病数的31%~43%。 (1)细菌感染:革兰阴性菌感染为DIC的最常见病因,如脑膜炎球菌、大肠埃希杆菌、铜绿假单胞菌等;某些严重革兰阳性菌感染,如金黄色葡萄球菌败血症等亦可导致DIC。偶有弥散性结核病并发DIC之报道。 (2)病毒感染:流行性出血热,重症肝炎等病毒性疾病,多种多发疹性病毒,如风疹病毒、麻疹病毒等。 (3)立克次体感染:如斑疹伤寒、姜片虫病等。 (4)原虫感染:如脑型疟疾。 (5)螺旋体感染:如钩端螺旋体病。 (6)真菌感染:如组织胞浆菌病。 2.恶性肿瘤 发病占DIC患者的24%~34%。常见者如各种类型的急性白血病、恶性淋巴瘤、前列腺癌、胰腺癌、肝癌、肾癌、肺癌、脑肿瘤、恶性血管内皮瘤、神经母细胞瘤、平滑肌肉瘤等。 3.病理产科 发病占DIC患者的4%~12%。常见如羊水栓塞、感染性流产、死胎滞留、重症妊娠高血压综合征、子宫破裂、胎盘早剥、前置胎盘等。 4.手术及创伤 发病占DIC的1%~5%,亦有报道高达15%者。富含组织因子的器官如脑、前列腺、胰腺、子宫及胎盘等,可因手术及创伤等致其释放而诱发DIC。大面积烧伤、严重挤压伤、骨折及蛇咬伤亦有导致DIC的。 5.医源性疾病 发病占DIC的4%~8%,其日趋升高的发病率已引起国内外学者的重视。医源性DIC的发生常与下列因素有关: (1)药物:多种解热镇痛药、某些生物及酶制剂、纤维蛋白溶解抑制剂、皮质激素及少数抗生素等。 (2)手术及其他医疗操作:某些大型手术及医疗操作可造成广泛性组织缺血、缺氧及损伤,导致组织凝血因子的释放、诱发DIC。 (3)肿瘤治疗:多种肿瘤细胞富含组织凝血因子类物质,在手术、放射及化学治疗的过程中,随着肿瘤细胞的破坏,此类物质可大量释放,通过外源性途径引起凝血反应,导致DIC的发生。 (4)不正常医疗过程: ①溶血性输血反应。 ②革兰阴性菌等污染性输入。 ③某些中药及大量非等渗性液体所致的严重溶血反应等。 6.全身各系统疾病 发病约占DIC的15%。 (1)心血管系统:恶性高血压、肺源性心脏病、心肌梗死、主动脉瘤、巨大血管瘤、非感染性血栓性心内膜炎、发绀性先天性心脏病及高脂血症等,其中肺心病并发DIC最为多见。 (2)呼吸系统:克雷伯肺炎、呼吸窘迫综合征。
[收起]
临床各科多种疾病均可导致DIC。常见者为感染、肿瘤、病理产科、手术及创伤。 1.感染性疾病 由感染所诱发的DIC占总发病数的31%~43%。 (1)细菌感染:革兰阴性菌感染为DIC的最常见病因,如脑膜炎球菌、大肠埃希杆菌、铜绿假单胞菌等;某些严重革兰阳性菌感染,如金黄色葡萄球菌败血症等亦可导致DIC。偶有弥散性结核病并发DIC之报道。 (2)病毒感染:流行性出血热,重症肝炎等病毒性疾病,多种多发疹性病毒,如风疹病毒、麻疹病毒等。 (3)立克次体感染:如斑疹伤寒、姜片虫病等。 (4)原虫感染:如脑型疟疾。 (5)螺旋体感染:如钩端螺旋...[详细]
DIC的发病机制甚为复杂,且可因基础疾病不同而异。现将其归纳如下: 1.外源凝血系统激活 在DIC的发病过程中,因子Ⅲ(组织因子)释入血流,通过外源性凝血系统触发凝血反应,导致微血栓形成,具有极其重要的作用。 除组织因子外,人体许多组织、细胞在损伤或破坏时亦可释放组织因子类物质。它们进入血流后,具有组织因子同样的活性和作用:①多种肿瘤细胞。②红细胞,主要为红细胞膜磷脂,即“红细胞素”。③白细胞,主要为其颗粒内容物。 一些进入血流的外源性物质,如某些蛇毒、昆虫毒素、羊水、胎儿或死胎脱落、坏死及代谢产物等亦具有组织因子样作用,在一定条件下,也是DIC的“始动”因素。 2.内源凝血途径启动 各种致病因素激活因子Ⅻ致内源性凝血系统激活,也是DIC发病机制中的重要一环。 可致因子Ⅻ激活的因素有:①血管内皮损伤,如严重感染、缺血、缺氧、酸中毒、某些药物及广泛性血管自身疾病等。②某些细菌、内毒素、病毒、凝血酶及某些药物等,有直接激活因子Ⅻ作用。③近年研究表明,活化的血小板在高相对分子质量激肽原及激肽释放酶存在的条件下,具有直接激活因子Ⅻ及Ⅺ作用。④血浆中游离饱和脂肪酸、某些抗原抗体复合物及医疗操作中的器械内表面等亦可直接激活因子Ⅻ。 3.血小板活化,促凝血反应 多种DIC致病因素可导致血小板损伤,使之在血管内皮处黏附、聚集及释放一系列内容及代谢产物。这些物质在DIC的发病机制中具有重要作用:①如上所述,活化血小板可直接激活因子Ⅻ,启动内凝血系统。②血小板活化后释放之血小板因子Ⅲ是凝血第1、2阶段中不可缺少的物质。它的出现可加速凝血过程。③活化的血小板释放的代谢产物如腺苷二磷酸、5-羟色胺、血栓烷A2等,具有诱导血小板聚集及强大收缩血管之作用,这将进一步加速DIC病理过程。在DIC过程中导致血小板活化的因素有:广泛的血管内皮损伤;某些微生物及其代谢产物,如病毒、内毒素等直接损伤血小板;外源或DIC早期形成的内源性凝血酶具有激活血小板的作用。 上述病理变化将导致体内凝血酶形成。凝血酶为DIC发病机制中的关键因素。它一方面直接使纤维蛋白原转化为纤维蛋白而形成血栓,同时通过对凝血因子及血小板等的强大正性反馈作用,进一步加速凝血过程,还可直接激活纤溶系统,加重凝血紊乱。凝血酶在DIC发病中的主要作用见图1。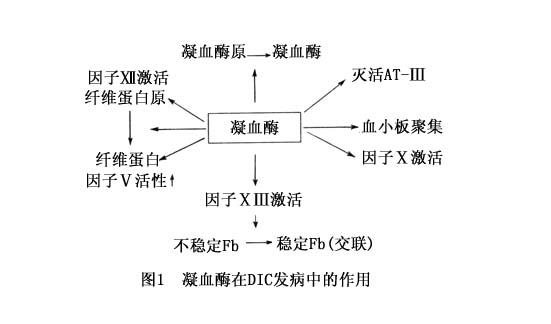 4.纤溶酶激活致凝血-抗凝失调进一步加重 在DIC发病中,起主要作用者除凝血酶之外,另一关键性因素是纤溶酶。近年来学者已将两者并列为DIC发病机制的关键性因素。 DIC过程中纤溶酶的激活因素如下:①活化的因子Ⅻ通过激活纤溶酶原活化物使纤溶酶原转化为纤溶酶。②先期形成的凝血酶具有强大的促纤溶酶形成作用。③许多外源及内源性物质,如某些细菌、病毒、内毒素、尿激酶、胸腔积液、腹水等,可直接促使纤溶酶原转变为纤溶酶。④血管内皮细胞富含组织型纤溶酶原激活剂(t-PA),在损伤或在纤维蛋白刺激下,可释入血流激活纤溶酶原。 纤溶酶在DIC中的作用如下:①降解纤维蛋白,清除血栓,但同时可引起迟发性出血。②多种纤维蛋白降解产物可影响血管通透性及血小板功能,而加重出血。③纤溶酶作为一种蛋白水解酶,可降解多种凝血因子。近年研究证明DIC患者的多种凝血因子减少,除血栓形成过程中的消耗之外,纤溶酶的降解可能也是一种重要原因。 5.微血栓形成 微血栓形成为DIC的基本病理变化,亦为DIC的特征性改变。微血栓的检出率,各家报道差异极大。有人发现感染性疾病导致DIC者可达50%,亦有阳性率高达90%的报道。DIC者微血栓存在部位极为广泛,多见于肺、肾、脑、肝、心、肾上腺、胃肠道及皮肤和黏膜等部位。 DIC微血栓的形态与其形成部位有关,可呈圆形、椭圆形、柱状、条索状、多角形等。在肾小球毛细血管中,则可呈不规则团块或蜂窝状及弧形条状。普通苏木精-伊红染色为一种均质无结构噬红色小体,常充满整个微血管中。血栓较大时,其周围或中央可有脂质溶解后形成的空泡,可有中性粒细胞等居于其中。血栓外周有时可见血小板沉着。血栓如以纤维素等特殊染色,则呈深蓝色均质状或薄雾状小体,形态等与苏木精-伊红染色者相似。电镜研究表明,不同部位微血栓的超微结构可有差异。微血栓在电镜下为边界清楚的团块,但无明确界膜。高倍放大时,可见微血栓由(50~60)nm×10nm的微粒子组成,间或出现22nm横纹状结构的纤维蛋白细束与血栓表面部位结合或覆盖于其上。DIC的肾小球超微结构则显示毛细血管内皮细胞肿胀、增生、管腔内被血小板、纤维蛋白或类纤维蛋白团块所堵塞,间有白细胞散布其间或密集成团。由羊水栓塞所引起的DIC,除微血栓外,在肺毛细血管内尚可发现羊水栓、羊水结晶及羊水内脱落细胞等成分。 DIC微血栓按其组成成分,可分成不同种类:①纤维蛋白血栓,为DIC微血栓的最主要组成部分。近来有人将纤维蛋白血栓分成管腔内无细胞反应型、管腔内伴细胞反应型、内皮外无纤维细胞反应型以及内皮外伴纤维细胞反应型等。②血小板血栓,为DIC早期血栓。主要由血小板聚集而成,由于血小板可以解聚而呈不稳定状态,因而在活性组织检查或尸检中较少发现。③血小板-纤维蛋白血栓,以纤维蛋白为核心,其中或外周有血小板沉积,此种血栓在DIC中亦较常见。④血小板-纤维蛋白-红细胞血栓,亦称混合血栓,多见于较大血管内,除血小板沉积及纤维蛋白凝块形成外,可混有红细胞。红细胞多被纤维蛋白分割包绕而散在,可有溶解而致含铁血黄素沉着,这种血栓在DIC中不多见。伴随微血管栓塞而出现的继发性病理变化有:血栓远端血管痉挛,间质水肿,灶状出血及缺血性坏死。因此,在有微血栓形成的脏器,可出现相应的一过性功能损害,甚至不可逆性的功能衰竭。 6.凝血功能异常 凝血功能异常是DIC最常见的病理生理变化,其检出率可高达90%~100%,其凝血演变过程如下: (1)初发性高凝期:此为DIC的早期改变。实验室检查凝血时间可明显缩短,凝血酶原时间缩短,其他凝血因子水平及活性正常或增高。 (2)消耗性低凝期:在高凝期过程进行的同时,由于高凝期的消耗及纤溶酶对凝血因子的降解,血液凝固性降低。实验室检查可发现凝血时间显著延长。血小板及多种凝血因子水平低下甚至不能测出。此期在DIC中持续时间较长,常构成DIC的主要临床特点及实验室检测异常。 (3)继发性纤溶亢进期:随着血管内血栓形成,大量血小板及凝血因子的消耗及代偿性抗凝增强,凝血过程渐趋减弱,纤溶过程则逐渐加强,且成为DIC病理过程中的主要矛盾,凝血时间显著延长,血块溶解、优球蛋白溶解及纤溶酶原测定等试验显示纤维蛋白溶解亢进。 (4)微循环障碍:微循环障碍为DIC中最常见的病理生理变化之一。其发生直接原因是广泛毛细血管微血栓形成,但还可能与下列因素有关:①DIC广泛出血导致血容量减少。②肺、肝、肠系统等部位广泛性栓塞而致肺动脉及门静脉压力升高,回心血量减少。③激肽系统激活,引起全身性血管扩张,血压下降。④纤维蛋白降解产物引起血管渗透性增高,血浆外渗,血容量进一步下降。⑤纤维蛋白溶解活性增强,纤维蛋白肽A、肽B增加,使血管收缩,致组织灌注进一步减少。⑥心肌内广泛血栓形成,心肌细胞肿胀变性,甚至坏死、断裂,心功能不全,导致搏出量减少。⑦原发病对循环系统的损害作用等。DIC微循环障碍可导致以下不良后果:①加重组织缺血、缺氧,引起代谢性酸中毒及其他代谢产物聚集。②毛细血管括约肌开始反射性痉挛,继之松弛扩张,更多毛细血管开放,血流愈趋缓慢、瘀滞。③组织、器官因栓塞、微循环障碍等原因,血流灌注进一步减少,并呈中毒性损害,造成一过性或持久性功能障碍。④由于毛细血管痉挛,血管内血栓形成及缺氧引起红细胞脆性增加,导致微血管病性溶血的发生。此种现象在毛细血管镜,特别是在扫描电镜下已得到了证实。
4.纤溶酶激活致凝血-抗凝失调进一步加重 在DIC发病中,起主要作用者除凝血酶之外,另一关键性因素是纤溶酶。近年来学者已将两者并列为DIC发病机制的关键性因素。 DIC过程中纤溶酶的激活因素如下:①活化的因子Ⅻ通过激活纤溶酶原活化物使纤溶酶原转化为纤溶酶。②先期形成的凝血酶具有强大的促纤溶酶形成作用。③许多外源及内源性物质,如某些细菌、病毒、内毒素、尿激酶、胸腔积液、腹水等,可直接促使纤溶酶原转变为纤溶酶。④血管内皮细胞富含组织型纤溶酶原激活剂(t-PA),在损伤或在纤维蛋白刺激下,可释入血流激活纤溶酶原。 纤溶酶在DIC中的作用如下:①降解纤维蛋白,清除血栓,但同时可引起迟发性出血。②多种纤维蛋白降解产物可影响血管通透性及血小板功能,而加重出血。③纤溶酶作为一种蛋白水解酶,可降解多种凝血因子。近年研究证明DIC患者的多种凝血因子减少,除血栓形成过程中的消耗之外,纤溶酶的降解可能也是一种重要原因。 5.微血栓形成 微血栓形成为DIC的基本病理变化,亦为DIC的特征性改变。微血栓的检出率,各家报道差异极大。有人发现感染性疾病导致DIC者可达50%,亦有阳性率高达90%的报道。DIC者微血栓存在部位极为广泛,多见于肺、肾、脑、肝、心、肾上腺、胃肠道及皮肤和黏膜等部位。 DIC微血栓的形态与其形成部位有关,可呈圆形、椭圆形、柱状、条索状、多角形等。在肾小球毛细血管中,则可呈不规则团块或蜂窝状及弧形条状。普通苏木精-伊红染色为一种均质无结构噬红色小体,常充满整个微血管中。血栓较大时,其周围或中央可有脂质溶解后形成的空泡,可有中性粒细胞等居于其中。血栓外周有时可见血小板沉着。血栓如以纤维素等特殊染色,则呈深蓝色均质状或薄雾状小体,形态等与苏木精-伊红染色者相似。电镜研究表明,不同部位微血栓的超微结构可有差异。微血栓在电镜下为边界清楚的团块,但无明确界膜。高倍放大时,可见微血栓由(50~60)nm×10nm的微粒子组成,间或出现22nm横纹状结构的纤维蛋白细束与血栓表面部位结合或覆盖于其上。DIC的肾小球超微结构则显示毛细血管内皮细胞肿胀、增生、管腔内被血小板、纤维蛋白或类纤维蛋白团块所堵塞,间有白细胞散布其间或密集成团。由羊水栓塞所引起的DIC,除微血栓外,在肺毛细血管内尚可发现羊水栓、羊水结晶及羊水内脱落细胞等成分。 DIC微血栓按其组成成分,可分成不同种类:①纤维蛋白血栓,为DIC微血栓的最主要组成部分。近来有人将纤维蛋白血栓分成管腔内无细胞反应型、管腔内伴细胞反应型、内皮外无纤维细胞反应型以及内皮外伴纤维细胞反应型等。②血小板血栓,为DIC早期血栓。主要由血小板聚集而成,由于血小板可以解聚而呈不稳定状态,因而在活性组织检查或尸检中较少发现。③血小板-纤维蛋白血栓,以纤维蛋白为核心,其中或外周有血小板沉积,此种血栓在DIC中亦较常见。④血小板-纤维蛋白-红细胞血栓,亦称混合血栓,多见于较大血管内,除血小板沉积及纤维蛋白凝块形成外,可混有红细胞。红细胞多被纤维蛋白分割包绕而散在,可有溶解而致含铁血黄素沉着,这种血栓在DIC中不多见。伴随微血管栓塞而出现的继发性病理变化有:血栓远端血管痉挛,间质水肿,灶状出血及缺血性坏死。因此,在有微血栓形成的脏器,可出现相应的一过性功能损害,甚至不可逆性的功能衰竭。 6.凝血功能异常 凝血功能异常是DIC最常见的病理生理变化,其检出率可高达90%~100%,其凝血演变过程如下: (1)初发性高凝期:此为DIC的早期改变。实验室检查凝血时间可明显缩短,凝血酶原时间缩短,其他凝血因子水平及活性正常或增高。 (2)消耗性低凝期:在高凝期过程进行的同时,由于高凝期的消耗及纤溶酶对凝血因子的降解,血液凝固性降低。实验室检查可发现凝血时间显著延长。血小板及多种凝血因子水平低下甚至不能测出。此期在DIC中持续时间较长,常构成DIC的主要临床特点及实验室检测异常。 (3)继发性纤溶亢进期:随着血管内血栓形成,大量血小板及凝血因子的消耗及代偿性抗凝增强,凝血过程渐趋减弱,纤溶过程则逐渐加强,且成为DIC病理过程中的主要矛盾,凝血时间显著延长,血块溶解、优球蛋白溶解及纤溶酶原测定等试验显示纤维蛋白溶解亢进。 (4)微循环障碍:微循环障碍为DIC中最常见的病理生理变化之一。其发生直接原因是广泛毛细血管微血栓形成,但还可能与下列因素有关:①DIC广泛出血导致血容量减少。②肺、肝、肠系统等部位广泛性栓塞而致肺动脉及门静脉压力升高,回心血量减少。③激肽系统激活,引起全身性血管扩张,血压下降。④纤维蛋白降解产物引起血管渗透性增高,血浆外渗,血容量进一步下降。⑤纤维蛋白溶解活性增强,纤维蛋白肽A、肽B增加,使血管收缩,致组织灌注进一步减少。⑥心肌内广泛血栓形成,心肌细胞肿胀变性,甚至坏死、断裂,心功能不全,导致搏出量减少。⑦原发病对循环系统的损害作用等。DIC微循环障碍可导致以下不良后果:①加重组织缺血、缺氧,引起代谢性酸中毒及其他代谢产物聚集。②毛细血管括约肌开始反射性痉挛,继之松弛扩张,更多毛细血管开放,血流愈趋缓慢、瘀滞。③组织、器官因栓塞、微循环障碍等原因,血流灌注进一步减少,并呈中毒性损害,造成一过性或持久性功能障碍。④由于毛细血管痉挛,血管内血栓形成及缺氧引起红细胞脆性增加,导致微血管病性溶血的发生。此种现象在毛细血管镜,特别是在扫描电镜下已得到了证实。
[收起]
DIC的发病机制甚为复杂,且可因基础疾病不同而异。现将其归纳如下: 1.外源凝血系统激活 在DIC的发病过程中,因子Ⅲ(组织因子)释入血流,通过外源性凝血系统触发凝血反应,导致微血栓形成,具有极其重要的作用。 除组织因子外,人体许多组织、细胞在损伤或破坏时亦可释放组织因子类物质。它们进入血流后,具有组织因子同样的活性和作用:①多种肿瘤细胞。②红细胞,主要为红细胞膜磷脂,即“红细胞素”。③白细胞,主要为其颗粒内容物。 一些进入血流的外源性物质,如某些蛇毒、昆虫毒素、羊水、胎儿或死胎脱落、坏死及代谢产物等亦具有组织因子样作用,在一定条件下,也是DIC的“始动”因素。...[详细]
DIC的临床表现与其原发病、临床类型以及所处的发展阶段有密切关系。由于DIC是发生于某些严重疾病基础上的一种临床综合征,而且仅存在于复杂病理过程的某一阶段,因此其临床表现可有以下特征:①由于引起DIC的原发病很多,因而DIC的临床表现常为原发病的症状和体征所掩盖。②DIC病理发展过程可有跳跃式的改变,故临床表现也有极大的变异性。③有的DIC患者(占13.5%~20%)除原发病症状和体征外,可无明显的DIC特异性表现。DIC在临床上最常见的4大症状为出血倾向、休克、栓塞及微血管病性溶血。 1.出血倾向 出血是DIC最常见的症状之一,有时甚至是提示DIC诊断的惟一临床依据。 (1)发生率:DIC出血发生率在84%~95.4%,甚至有认为可达100%者。DIC出血发生率的差异,可能与基础疾病有别、临床类型各异,以及诊断时病期的不同有关。 (2)特征及部位:DIC出血多数为自发性、持续性渗血。出血部位可遍及全身,多见于皮肤、黏膜、牙龈、伤口及穿刺部位。其次为某些内脏较大量的出血,可表现为咯血、呕血、血尿、黑便和颅内出血等。 (3)临床特点:除极少数病例外,DIC之出血倾向有以下临床特点: ①出血多突然发生,常不易用原发病或原发病当时的症状解释,且患者多无既往出血病史。 ②出血部位广泛,呈多发性,即往往同时有2个以上的部位有出血症状。据前同济医科大学附属协和医院256例DIC统计,有2个部位同时出血者79例,占30.9%;3个部位同时出血者22例,占8.6%,而单一部位出血所占比例甚少。 ③出血多伴有DIC其他临床表现,如休克、皮肤栓塞坏死及脏器功能不全等。 ④常规止血治疗措施如纤溶抑制剂及单纯输血或凝血因子补充等,疗效多不显著,有时反可加重病情,而抗凝治疗等综合措施常有一定疗效。 2.休克或微循环衰竭 休克或微循环衰竭为DIC最重要和最常见的临床表现之一。其发病率在30%~80%之间。Matsuda 136例DIC患者,33%有休克;前同济医科大学附属协和医院256例中,有休克表现者占46.5%。 临床特点:DIC所致的休克或微循环衰竭,除有一般休克的表现外,临床上常有以下特点:①休克突然发生,临床不能找到最常见的休克原因,如失血、中毒、过敏及剧烈疼痛等。②休克常与出血倾向、栓塞等DIC其他表现同时出现,但休克与出血的严重程度多不一致。③休克早期即可出现多种脏器,特别是生命重要器官功能不全的症状及体征,如肾、肺及大脑皮质功能不全等。此与一般休克仅在末期才出现上述表现迥然不同。④休克多属难治性,临床上病情重笃,常规治疗效果不显或甚至可能加重病情。 3.微血管栓塞症 (1)发生率:由于DIC病情不同,所取标本部位及检查方法的差异,DIC血栓栓塞症发生率差异甚大。 (2)临床特点: ①DIC的栓塞为微血管栓塞:分布广泛而且弥散,通常甚少出现血栓形成或栓塞的局部定位症状及体征,因此不能以传统的观念及方法来寻找DIC栓塞的临床及影像学证据。 ②许多DIC患者的栓塞为体表浅层栓塞:主要表现为皮肤、黏膜的发绀,进而发展为广泛性血栓栓塞性坏死。此时皮肤上可见点状或斑状淤斑,病灶中心有高出皮面的暗红色小血栓,其周围包绕以大小不等的片状颜色稍淡的出血灶。随着病情的发展,血栓周围的出血斑可因缺血、缺氧而坏死,并可有表皮脱落。坏死灶常呈散在性分布,多见于眼睑、四肢、胸背及会阴部等皮下脂肪较多,组织松软的部位。黏膜的损害与皮肤类似,易发生于口腔、消化道、肛门等部位,可呈弥散性灶性坏死及溃疡形成,亦可为大片斑状坏死、脱落,可引起上消化道大出血等症状。 ③一些DIC患者的栓塞发生于体腔深部:特别是各生命重要器官。此时栓塞的证据除少数能通过活检直接检出血栓之外,大多数表现为有关脏器的功能衰竭。据前同济医科大学附属协和医院和其他医院的病例统计资料,DIC的脏器栓塞发生率最高者为肾脏,约占54%;其次为肺。主要表现为呼吸窘迫综合征及呼吸功能不全,约占44.6%;再次为大脑皮质弥散性栓塞,表现为不同程度的意识障碍及原因不明的颅内高压综合征,约占24%;少数可有脑血栓形成的症状和体征。其他尚有心肌及肝脏微血管栓塞,肾上腺皮质、垂体或肠系膜栓塞等,此时可产生相应器官一过性或永久性功能障碍。 DIC所致各组织、器官血栓栓塞及功能紊乱的发生率,见表1。 4.微血管病性溶血 DIC可发现的溶血约见于25%的患者。它所引起的红细胞破坏在DIC诊断上具有极重要的价值。 DIC溶血的发生,主要由以下因素引起:①DIC时毛细血管内广泛血栓形成并有反射性血管痉挛,故管腔高度狭窄,红细胞通过此种狭窄的毛细血管时,受机械性作用而变形、破坏,此为DIC溶血的主要原因(故称微血管病性溶血)。②毛细血管内的纤维蛋白血栓,其表面不甚光滑,存在着许多纤维蛋白丝等附着物。它们可对循环中的红细胞产生拽挂、挤压等机械性损伤,加重红细胞的破坏。③患者的红细胞因缺血、缺氧、代谢毒性产物的作用,致机械脆性增加。 DIC溶血在临床上表现为微血管病性血管内溶血,常有以下特点:①多数缺乏典型急性血管内溶血的症状和特征,如畏寒、发热、腰痛、黄疸等。此可能与溶血程度较轻有关。②部分病例中,不明原因的进行性贫血,或血常规检测时进行性血红蛋白下降,可能是提示DIC溶血反应的惟一证据。③由于微血管病是DIC溶血的主要原因,因此患者红细胞破坏的证据较为明显,如血片中可见大量红细胞碎片和破碎红细胞,以及呈三角形、盔形、棘状等异形红细胞。 5.原发疾病临床表现 除上述主要临床表现外,尚有引起DIC的基础疾病的相应症状及体征,如感染、肿瘤、病理产科、手术及创伤等,均各有其相应的临床表现。 6.其他 DIC的其他临床表现,在文献上尚有:①新生儿DIC主要表现为肢端发冷、精神萎靡、面色青灰或苍白、鼻翼扇动、呼吸不规则、不啼哭或啼声过低、皮肤硬肿、抽搐等。②DIC时皮肤除有出血点、斑块状坏死之外,尚可有暴发性紫癜、指(趾)端发绀及坏死,少数可表现为鼻部坏死。[收起]
DIC的临床表现与其原发病、临床类型以及所处的发展阶段有密切关系。由于DIC是发生于某些严重疾病基础上的一种临床综合征,而且仅存在于复杂病理过程的某一阶段,因此其临床表现可有以下特征:①由于引起DIC的原发病很多,因而DIC的临床表现常为原发病的症状和体征所掩盖。②DIC病理发展过程可有跳跃式的改变,故临床表现也有极大的变异性。③有的DIC患者(占13.5%~20%)除原发病症状和体征外,可无明显的DIC特异性表现。DIC在临床上最常见的4大症状为出血倾向、休克、栓塞及微血管病性溶血。 1.出血倾向 出血是DIC最常见的症状之一,有时甚至是提示DIC诊断的惟一临床依据。 ...[详细]
4.微血管病性溶血 DIC可发现的溶血约见于25%的患者。它所引起的红细胞破坏在DIC诊断上具有极重要的价值。 DIC溶血的发生,主要由以下因素引起:①DIC时毛细血管内广泛血栓形成并有反射性血管痉挛,故管腔高度狭窄,红细胞通过此种狭窄的毛细血管时,受机械性作用而变形、破坏,此为DIC溶血的主要原因(故称微血管病性溶血)。②毛细血管内的纤维蛋白血栓,其表面不甚光滑,存在着许多纤维蛋白丝等附着物。它们可对循环中的红细胞产生拽挂、挤压等机械性损伤,加重红细胞的破坏。③患者的红细胞因缺血、缺氧、代谢毒性产物的作用,致机械脆性增加。 DIC溶血在临床上表现为微血管病性血管内溶血,常有以下特点:①多数缺乏典型急性血管内溶血的症状和特征,如畏寒、发热、腰痛、黄疸等。此可能与溶血程度较轻有关。②部分病例中,不明原因的进行性贫血,或血常规检测时进行性血红蛋白下降,可能是提示DIC溶血反应的惟一证据。③由于微血管病是DIC溶血的主要原因,因此患者红细胞破坏的证据较为明显,如血片中可见大量红细胞碎片和破碎红细胞,以及呈三角形、盔形、棘状等异形红细胞。 5.原发疾病临床表现 除上述主要临床表现外,尚有引起DIC的基础疾病的相应症状及体征,如感染、肿瘤、病理产科、手术及创伤等,均各有其相应的临床表现。 6.其他 DIC的其他临床表现,在文献上尚有:①新生儿DIC主要表现为肢端发冷、精神萎靡、面色青灰或苍白、鼻翼扇动、呼吸不规则、不啼哭或啼声过低、皮肤硬肿、抽搐等。②DIC时皮肤除有出血点、斑块状坏死之外,尚可有暴发性紫癜、指(趾)端发绀及坏死,少数可表现为鼻部坏死。[收起]
DIC的临床表现与其原发病、临床类型以及所处的发展阶段有密切关系。由于DIC是发生于某些严重疾病基础上的一种临床综合征,而且仅存在于复杂病理过程的某一阶段,因此其临床表现可有以下特征:①由于引起DIC的原发病很多,因而DIC的临床表现常为原发病的症状和体征所掩盖。②DIC病理发展过程可有跳跃式的改变,故临床表现也有极大的变异性。③有的DIC患者(占13.5%~20%)除原发病症状和体征外,可无明显的DIC特异性表现。DIC在临床上最常见的4大症状为出血倾向、休克、栓塞及微血管病性溶血。 1.出血倾向 出血是DIC最常见的症状之一,有时甚至是提示DIC诊断的惟一临床依据。 ...[详细]
肺栓塞,可致急性呼吸窘迫综合征;肾栓塞,可致急性肾衰;脑栓塞,可致脑水肿或脑疝;肝栓塞,可致肝功能衰竭。
DIC实验室检查的基本要求有三:①由于DIC多数起病急骤,发展迅猛,故除研究性者外,实验室检查力求简便快速,一般应在2h内能出具检测结果报告。②目前大多数DIC实验项目尚不具备诊断特异性,因此实验检测意义应密切结合临床,综合分析。③多项凝血检测正常值,生理波动范围较大,DIC不同阶段的实验检测结果亦有差异,因此动态检测对DIC的诊断价值更大。 1.血小板量与质 (1)血小板计数减少:血小板减少是DIC最常见、最重要的实验室异常。Danus等认为,在非血小板增多性疾病患者,如果血小板数超过150×109/L,基本上可排除DIC诊断。DIC血小板减少的发生率一般在90%左右,而且多为重度减少。 (2)平均血小板体积增大:循环中血小板正常体积平均为(10.46±2.80)fl,在DIC时,由于血小板大量破坏,年轻的血小板比例增加,故平均体积增大,可达(12.8±3.6)fl,而体积增大是血小板破坏加速的证据之一。 (3)血小板功能异常:获得性血小板功能缺陷也是DIC常见的实验异常之一。在急性和慢性DIC,其异常率可达50%和90%。主要表现为:①聚集功能异常,早期聚集性增强,随后降低。DIC时纤维蛋白降解产物的形成,特别是早期纤维蛋白降解产物碎片X、Y可抑制血小板聚集。②抗纤维蛋白溶解活性明显降低。③黏附性异常,DIC早期黏附性增强,中、晚期可降低。 (4)释放及代谢产物增加:DIC发病过程中,由于原发病,广泛血管内皮损伤及凝血酶等的作用,血小板大量活化,血浆中其释放及代谢产物明显增加,其中某些血小板特异性分子标志物的检测对DIC特别是慢性DIC的诊断具有较大意义。 ①血小板因子Ⅳ(PF4):PF4为血小板特异性蛋白之一。Fuster等动物实验发现,慢性DIC之犬,其PF4含量及活性增高2倍。我们的临床检测,亦证实此一变化,异常率约为70%。 ②血栓烷B2(TXB2):TXB2为血小板花生四烯酸的最终代谢产物之一。DIC时血浆TXB2明显增加,异常率可达90%左右。 ③血小板α颗粒膜蛋白140(GMP-140):GMP-140是血小板α颗粒膜、致密颗粒及溶酶体所特有的一种糖蛋白。新近发现血管内皮细胞中亦有其存在。DIC时,随着血小板的活化及破坏,GMP-140可释人血流或螯合于血小板表面,故血浆中及血小板表面分子数均可增加。 2.凝血因子有关实验 既往的DIC实验检测中,传统凝血实验如纤维蛋白原,凝血酶原时间,APIT,因子Ⅴ、Ⅶ等,具有较重要的价值。近年来由于许多高灵敏度及特异性检测方法的开展,除纤维蛋白原外,其余项目的重要性已日趋降低。 (1)纤维蛋白原:DIC患者血中纤维蛋白原减低甚为多见,其发生率约为70%。但DIC早期可呈升高。目前国内多以低于1.5g/L.或高于4.0g/L为减低或升高的标准。 (2)凝血酶原时间(PT):凝血酶原,因子Ⅴ、Ⅶ、Ⅹ及纤维蛋白原中任何一种因子的减少或缺乏,均可造成PT结果异常。DIC由于有前述多种凝血因子的大量消耗及降解,PT延长的发生率可高达85%~100%。通常以正常对照值(12~13s)延长3s以上为异常。DIC早期,由于血液处于高凝状态,故PT缩短亦有一定的诊断意义。 (3)凝血酶凝固时间(TT):影响TT结果的主要因素有三:①血浆纤维蛋白原含量减少;②血中肝素样物质增多。③血中纤维蛋白降解产物含量增高。由于DIC时上述因素均有可能出现异常,故TT延长极为多见,阳性率可达62%~85%。一般认为比正常对照值(17~22s)延长3s者,有助于DIC诊断。 (4)激活的部分凝血激酶时间(APIT):DIC时由于有多种凝血因子的消耗性减少及降解,APTT试验延长较多见。阳性率可达60%~70%。APIT正常值各实验室稍有差异。在40~50s。一般认为比正常对照值延长10s以上可有诊断意义。 (5)其他凝血因子测定:如因子Ⅷ:C、Ⅴ、Ⅶ、Ⅹ、Ⅻ,以及蛋白C、蛋白S测定,对DIC的诊断有一定的帮助。其中Ⅷ:C测定在肝病合并DIC的诊断上有重要价值。 3.纤维蛋白单体(FM)及其复合物测定 按目前的认识,纤维蛋白形成及其降解产物产生,为患者有高凝血酶血症的重要依据。DIC时既有纤维蛋白形成的加速,又有继发性纤溶亢进,因此FM及纤维蛋白(原)降解产物(FDP)均呈增加,由FM与FDP形成的可溶性复合物也随之增多。 (1)鱼精蛋白副凝固(3P)试验:鱼精蛋白能与FDP结合,使FM从可溶性FM-FDP复合物中分离出来,进而聚合形成纤维蛋白。DIC时此试验阳性率较高,在36.8%~78.3%。由于3P试验操作简单,阳性率较高,并有一定特异性,因此被视为DIC诊断中的一项重要实验指标。 (2)乙醇胶(EGF)试验:本试验的原理及意义与3P试验相同,其在DIC的阳性率较低,约为50%,但特异性较高。 (3)可溶性纤维蛋白单体复合物(SFMC)测定:DIC患者SFMC增高,纤维蛋白原降低,因而SFMC/纤维蛋白原比值明显升高。而在手术或其他某些疾病时,尽管有SFMC增加,但由于纤维蛋白原往往有应激性增加,故其比值仅轻、中度升高,故有助于DIC与某些类似疾病的鉴别。 4.纤维蛋白溶解测定 继发性纤维蛋白溶解亢进为DIC中、后期的重要病理变化之一,因而相应指标的检测在DIC特别是中、后期的诊断上具有重要意义。 (1)优球蛋白溶解试验(ELT):由于在酸性环境下沉淀的优球蛋白内含有纤溶酶原激活剂,因此可以由优球蛋白溶解速度测定纤维酶原激活剂的相对含量。纤溶亢进时,优球蛋白溶解时间常明显缩短(正常>120min)。本试验在DIC的阳性率较低,为28%-38%。(2)纤溶酶原(PLG)测定:DIC中、后期由于纤溶系统被激活,使大量纤溶酶原转化为纤溶酶,故血中纤溶酶原水平下降,正常值(刚果红显色法)3.5KU/L±0.7KU/L,DIC时阳性率为50%-70%。(3)纤维蛋白/纤维蛋白原降解产物(FDP)测定:由于DIC中、后期纤维蛋白溶解亢进的发生率极高,因此FDP测定也是DIC的重要指标之一。
[收起]
DIC实验室检查的基本要求有三:①由于DIC多数起病急骤,发展迅猛,故除研究性者外,实验室检查力求简便快速,一般应在2h内能出具检测结果报告。②目前大多数DIC实验项目尚不具备诊断特异性,因此实验检测意义应密切结合临床,综合分析。③多项凝血检测正常值,生理波动范围较大,DIC不同阶段的实验检测结果亦有差异,因此动态检测对DIC的诊断价值更大。 1.血小板量与质 (1)血小板计数减少:血小板减少是DIC最常见、最重要的实验室异常。Danus等认为,在非血小板增多性疾病患者,如果血小板数超过150×109/L,基本上可排除DIC诊断。DIC血小板减少的发生率一般在90%左右,而...[详细]
1.外周血破碎红细胞观察 国内及日本某些学者对此试验甚为重视,认为它是在急诊或实验条件不足的情况下,诊断DIC的重要方法之一。由于DIC时微血管栓塞、痉挛及微血管病性溶血,故红细胞破坏而造成血中出现大量破碎红细胞及其碎片,并有多种畸形红细胞,如盔形、三角形、棘状红细胞等,外周血破碎红细胞超过10%,是DIC的重要佐征之一。 2.抗凝血酶Ⅲ(AT-Ⅲ)测定 AT-Ⅲ为人体内最重要的生理性抗凝物质之一,具有抗凝血酶.抑制因子Ⅸa、Ⅹa、Ⅻa及纤溶酶作用。DIC时由于凝血因子的激活,导致AT-Ⅲ的大量消耗,以致血中浓度减低(正常值0.2~0.4g/L),活性下降(正常值80%~120%),异常率为80%左右。AT-Ⅲ活性降低,还影响肝素等抗凝治疗的疗效,因而AT-Ⅲ的测定对DIC不仅有诊断意义,而且还有指导治疗的价值。近年发现,DIC经有效治疗后,AT-Ⅲ活性可迅速回升,故是DIC的一项较好的疗效监测指标。 3.蛋白C(PC)测定 据美国西北大学医学院曹中信测定,DIC时抗原水平呈显著降低(正常5mg/L),阳性率在86%以上,而血栓性血小板减少性紫癜(TTP)患者PC水平正常,故认为此项试验可能有助于DIC与TTP的鉴别。 4.纤维蛋白生成与转换率测定 有些所谓非临床型DIC患者,既无临床症状,又无常规实验检查异常,仅有纤维蛋白生成及转换率加速。此种试验目前尚在探索阶段,从理论上推测可能是诊断DIC的一种敏感指标。 5.与凝血有关的分子标记物测定 在内皮损伤、血小板活化及凝血激活的过程中,血管内皮、血小板及凝血因子可分泌、释放或降解出多种具有特异性标记意义的物质,称作分子标记物。 除前述血小板活化及代谢产物外,目前较为成熟的检测项目主要有: (1)凝血酶-抗凝血酶复合物(TAT):本试验主要间接测定凝血酶的激活状态及其血浆水平。 (2)凝血酶原碎片1+2(Fl 2):Fl 2为凝血酶原转变为凝血酶过程中的降解产物,故其水平直接反映凝血酶的激活水平。 (3)D-二聚体(D-dimer):D-dimer为交联纤维蛋白的降解产物,是人体内纤维蛋白形成并有降解发生的特异性分子标记物之一。 (4)纤维蛋白肽A(fibrinopeptide A,FPA):FPA是纤维蛋白原在凝血酶作用下转变为纤维蛋白过程中最先释放出的肽链片段,其在血(尿)中水平增高,可间接反映凝血酶活性增高及凝血激活过程的启动。 (5)内皮缩血管肽(endothelin,ET):ET主要是血管内皮合成的一种具有强烈收缩血管及调节凝血及纤溶的生物活性物质,在血管内皮细胞损伤时释放入血ET升高,可敏感而特异地反映内皮细胞合成ET的能力及内皮损伤程度。 (6)凝血酶调节蛋白(thrombomodulin,TM):TM由内皮细胞合成,为凝血酶受体。TM与凝血酶形成之复合物具有极强的激活蛋白C之作用。血浆TM水平主要反映内皮合成TM的能力及内皮损伤程度。 与DIC诊断有关的分子标记物及其意义,见表2。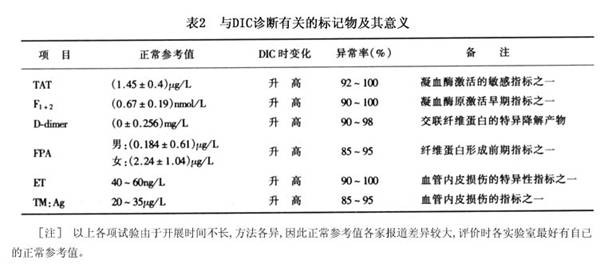 [收起]
1.外周血破碎红细胞观察 国内及日本某些学者对此试验甚为重视,认为它是在急诊或实验条件不足的情况下,诊断DIC的重要方法之一。由于DIC时微血管栓塞、痉挛及微血管病性溶血,故红细胞破坏而造成血中出现大量破碎红细胞及其碎片,并有多种畸形红细胞,如盔形、三角形、棘状红细胞等,外周血破碎红细胞超过10%,是DIC的重要佐征之一。 2.抗凝血酶Ⅲ(AT-Ⅲ)测定 AT-Ⅲ为人体内最重要的生理性抗凝物质之一,具有抗凝血酶.抑制因子Ⅸa、Ⅹa、Ⅻa及纤溶酶作用。DIC时由于凝血因子的激活,导致AT-Ⅲ的大量消耗,以致血中浓度减低(正常值0.2~0.4g/L),活性下降(正常值80%~120%...[详细]
[收起]
1.外周血破碎红细胞观察 国内及日本某些学者对此试验甚为重视,认为它是在急诊或实验条件不足的情况下,诊断DIC的重要方法之一。由于DIC时微血管栓塞、痉挛及微血管病性溶血,故红细胞破坏而造成血中出现大量破碎红细胞及其碎片,并有多种畸形红细胞,如盔形、三角形、棘状红细胞等,外周血破碎红细胞超过10%,是DIC的重要佐征之一。 2.抗凝血酶Ⅲ(AT-Ⅲ)测定 AT-Ⅲ为人体内最重要的生理性抗凝物质之一,具有抗凝血酶.抑制因子Ⅸa、Ⅹa、Ⅻa及纤溶酶作用。DIC时由于凝血因子的激活,导致AT-Ⅲ的大量消耗,以致血中浓度减低(正常值0.2~0.4g/L),活性下降(正常值80%~120%...[详细]
1.国内标准 1995年全国第五届血栓与止血会议(武汉)制定的诊断标准如下: (1)临床表现:①存在易引起DIC的基础疾病。②有下列2项以上临床表现:A.多发性出血倾向;B.不易用原发病解释的微循环衰竭或休克;C.多发性微血管栓塞的症状、体征,如皮肤、皮下、黏膜栓塞性坏死,以及早期出现的肺、肾、脑等脏器功能不全;D.抗凝治疗有效。 (2)实验室指标:同时有下列3项以上异常:①血小板<100×109/L或呈进行性下降(肝病、白血病、血小板<50×109/L);或有2项以上血浆血小板活化产物升高:β-TG,PF4,TXB2,GMP-140。②血浆纤维蛋白原含量<1.5g/L或进行性下降或>4g/L(白血病及其他恶性肿瘤<1.8g/L,肝病<1.0g/L)。③3P试验阳性或血浆FDP>20mg/L(肝病:FDP>60mg/L),或D-二聚体水平升高(阳性)。④凝血酶原时间缩短或延长3s以上或呈动态变化(肝病:凝血酶原时间延长5s以上)。⑤纤溶酶原含量及活性降低。⑥AT-Ⅲ含量及活性降低(不适用于肝病)。⑦血浆因子Ⅷ:C活性<50%(肝病必备)。 疑难病例应有下列1项以上异常:①因子Ⅷ:C降低,vWF:Ag升高,Ⅷ:C/vWF:Ag比值降低。②血浆TAT浓度升高,或F1 2水平升高。③血浆纤溶酶-纤溶酶抑制物复合物(PIC)浓度升高。④血(尿)纤维蛋白肽A水平增高。 2.国外常用标准 (1)Colman标准:Colman l971年最先提出的DIC(实验)诊断指标。①血小板减少(<100×109/L)。②凝血酶原时间延长。③纤维蛋白原降低(<1.5g/L)。如以上3项中仅2项异常,则需有以下3项中的1项以上异常:①凝血酶凝固时间延长。②血清中FDP较正常增高4倍(或3P试验阳性)。③优球蛋白溶解时间缩短。 (2)日本计分诊断标准为日本学者近年所提出(表3)。 3.诊断评析 (1)DIC微血栓栓塞的表现缺乏特异性:在急性DIC时持续时间也较短,往往被临床医师忽视,或不被发现,或被归因于原发病。实际上,微血栓的广泛形成而非出血才是导致组织缺氧及脏器功能不全的最常见原因。如果能在高凝期诊断并治疗DIC,会明显改善预后。DIC出血是机体凝血和造血功能失代偿的表现,主要特点为全身性多部位出血,常无法用原发病解释。认识DIC的临床特点、提高对DIC的警惕性、对存在易于发生DIC的基础疾病的患者常规监测DIC,是早期诊断DIC的关键。 (2)DIC的实验室检查缺乏特异性:不能凭借某一项或某几项试验来确诊DIC。这也是国际上始终未能制定出公认的诊断标准的主要原因。国内制定的诊断标准虽然全面,但通过这几年的运用,有学者认为仍存在不少问题。例如,过于烦琐,有些项目费时、费力,费用高,可操作性差等。国外有学者认为,实际上,如果PT、APTT、纤维蛋白原定量和血小板计数均异常,又有DIC的原发病因和典型的临床表现,诊断基本成立。 在分析化验结果还应注意以下几点:①纤维蛋白原正常不能轻易排除急性DIC的诊断,因为纤维蛋白原为急性相反应蛋白,可因为DIC原发病而增高。当怀疑DIC时,若纤维蛋白原从极高水平骤降至正常低值对诊断有帮助。相反,纤维蛋白原水平极低也并非DIC的特异性诊断指标,譬如许多肝脏疾病的晚期可出现低纤维蛋白原血症。②应强调动态监测血小板,如果短时间内血小板进行性降低,在排除了其他原因之后应想到DIC。③3P试验是用来测定血浆中可溶性纤维蛋白单体复合物,间接反映凝血酶的生成,但可有假阳性,如各种外伤、大手术时。相反,DIC晚期纤维蛋白原极度减少时因几乎没有纤维蛋白单体的进一步生成,3P试验可出现阴性反应。④FDP是纤溶酶降解纤维蛋白和(或)纤维蛋白原的产物,FDP升高提示纤溶酶的生成。但其他血栓性疾病,如深静脉血栓等也可出现FDP的升高。⑤D-二聚体是纤溶酶降解交联的纤维蛋白产生的片段,与FDP相同,其他血栓性疾病也可能出现D-二聚体阳性。 (3)以往曾根据病理生理改变将DIC分为3期:高凝期、消耗性低凝期和纤溶亢进期。这主要取决于凝血酶和纤溶酶活性之间的平衡以及机体的代偿情况等。虽然在临床上往往很难将这3个期截然划分开来,但如能进行初步划分,对治疗方案的选择有一定参考价值。高凝期为DIC的早期,凝血因子相继被激活,血液凝固性增高,大量形成的凝血酶引起微血管内弥散性微血栓形成,导致受累脏器的功能障碍。此时,由于机体的代偿功能良好,血小板和凝血因子水平基本正常,甚至高于正常水平。此期的治疗除了控制原发病外,主要是给以抗凝,而不宜输注凝血因子和血小板,禁用抗纤溶药。消耗性低凝期时由于血小板和凝血因子的大量消耗,超越了机体的代偿能力,或血小板和凝血因子消耗过快,机体来不及代偿,故血小板降低,多种凝血因子缺乏,由此产生凝血功能障碍,临床上大多有出血表现。此期的治疗需在高凝期治疗的基础上,补充凝血因子和(或)血小板。纤溶亢进期时纤溶酶降解纤维蛋白和纤维蛋白原产生大量可干扰止血功能的FDP。另外,纤溶酶还降解因子Ⅴ和因子Ⅷ等使凝血因子进一步降低,出血表现更为明显。此期的治疗需在消耗性低凝期治疗的基础上,酌情给以抗纤溶等治疗。 (4)对于DIC的早期诊断或前DIC的诊断:人们一直在进行不懈研究,但此问题仍未得到解决。其主要原因是前面提到的DIC临床表现和实验室检查缺乏特异性。即使有的检查项目,如凝血酶原碎片1+2(F1+2)和凝血酶-抗凝血酶(TAT)等,可能对诊断有帮助,但由于费用高、不能快速出结果等因素的限制,一时还无法广泛应用于临床。[收起]
1.国内标准 1995年全国第五届血栓与止血会议(武汉)制定的诊断标准如下: (1)临床表现:①存在易引起DIC的基础疾病。②有下列2项以上临床表现:A.多发性出血倾向;B.不易用原发病解释的微循环衰竭或休克;C.多发性微血管栓塞的症状、体征,如皮肤、皮下、黏膜栓塞性坏死,以及早期出现的肺、肾、脑等脏器功能不全;D.抗凝治疗有效。 (2)实验室指标:同时有下列3项以上异常:①血小板<100×109/L或呈进行性下降(肝病、白血病、血小板<50×109/L);或有2项以上血浆血小板活化产物升高:β-TG,PF4,TXB2,GMP-140。②血浆纤维蛋白原含量<1.5g/L或...[详细]
3.诊断评析 (1)DIC微血栓栓塞的表现缺乏特异性:在急性DIC时持续时间也较短,往往被临床医师忽视,或不被发现,或被归因于原发病。实际上,微血栓的广泛形成而非出血才是导致组织缺氧及脏器功能不全的最常见原因。如果能在高凝期诊断并治疗DIC,会明显改善预后。DIC出血是机体凝血和造血功能失代偿的表现,主要特点为全身性多部位出血,常无法用原发病解释。认识DIC的临床特点、提高对DIC的警惕性、对存在易于发生DIC的基础疾病的患者常规监测DIC,是早期诊断DIC的关键。 (2)DIC的实验室检查缺乏特异性:不能凭借某一项或某几项试验来确诊DIC。这也是国际上始终未能制定出公认的诊断标准的主要原因。国内制定的诊断标准虽然全面,但通过这几年的运用,有学者认为仍存在不少问题。例如,过于烦琐,有些项目费时、费力,费用高,可操作性差等。国外有学者认为,实际上,如果PT、APTT、纤维蛋白原定量和血小板计数均异常,又有DIC的原发病因和典型的临床表现,诊断基本成立。 在分析化验结果还应注意以下几点:①纤维蛋白原正常不能轻易排除急性DIC的诊断,因为纤维蛋白原为急性相反应蛋白,可因为DIC原发病而增高。当怀疑DIC时,若纤维蛋白原从极高水平骤降至正常低值对诊断有帮助。相反,纤维蛋白原水平极低也并非DIC的特异性诊断指标,譬如许多肝脏疾病的晚期可出现低纤维蛋白原血症。②应强调动态监测血小板,如果短时间内血小板进行性降低,在排除了其他原因之后应想到DIC。③3P试验是用来测定血浆中可溶性纤维蛋白单体复合物,间接反映凝血酶的生成,但可有假阳性,如各种外伤、大手术时。相反,DIC晚期纤维蛋白原极度减少时因几乎没有纤维蛋白单体的进一步生成,3P试验可出现阴性反应。④FDP是纤溶酶降解纤维蛋白和(或)纤维蛋白原的产物,FDP升高提示纤溶酶的生成。但其他血栓性疾病,如深静脉血栓等也可出现FDP的升高。⑤D-二聚体是纤溶酶降解交联的纤维蛋白产生的片段,与FDP相同,其他血栓性疾病也可能出现D-二聚体阳性。 (3)以往曾根据病理生理改变将DIC分为3期:高凝期、消耗性低凝期和纤溶亢进期。这主要取决于凝血酶和纤溶酶活性之间的平衡以及机体的代偿情况等。虽然在临床上往往很难将这3个期截然划分开来,但如能进行初步划分,对治疗方案的选择有一定参考价值。高凝期为DIC的早期,凝血因子相继被激活,血液凝固性增高,大量形成的凝血酶引起微血管内弥散性微血栓形成,导致受累脏器的功能障碍。此时,由于机体的代偿功能良好,血小板和凝血因子水平基本正常,甚至高于正常水平。此期的治疗除了控制原发病外,主要是给以抗凝,而不宜输注凝血因子和血小板,禁用抗纤溶药。消耗性低凝期时由于血小板和凝血因子的大量消耗,超越了机体的代偿能力,或血小板和凝血因子消耗过快,机体来不及代偿,故血小板降低,多种凝血因子缺乏,由此产生凝血功能障碍,临床上大多有出血表现。此期的治疗需在高凝期治疗的基础上,补充凝血因子和(或)血小板。纤溶亢进期时纤溶酶降解纤维蛋白和纤维蛋白原产生大量可干扰止血功能的FDP。另外,纤溶酶还降解因子Ⅴ和因子Ⅷ等使凝血因子进一步降低,出血表现更为明显。此期的治疗需在消耗性低凝期治疗的基础上,酌情给以抗纤溶等治疗。 (4)对于DIC的早期诊断或前DIC的诊断:人们一直在进行不懈研究,但此问题仍未得到解决。其主要原因是前面提到的DIC临床表现和实验室检查缺乏特异性。即使有的检查项目,如凝血酶原碎片1+2(F1+2)和凝血酶-抗凝血酶(TAT)等,可能对诊断有帮助,但由于费用高、不能快速出结果等因素的限制,一时还无法广泛应用于临床。[收起]
1.国内标准 1995年全国第五届血栓与止血会议(武汉)制定的诊断标准如下: (1)临床表现:①存在易引起DIC的基础疾病。②有下列2项以上临床表现:A.多发性出血倾向;B.不易用原发病解释的微循环衰竭或休克;C.多发性微血管栓塞的症状、体征,如皮肤、皮下、黏膜栓塞性坏死,以及早期出现的肺、肾、脑等脏器功能不全;D.抗凝治疗有效。 (2)实验室指标:同时有下列3项以上异常:①血小板<100×109/L或呈进行性下降(肝病、白血病、血小板<50×109/L);或有2项以上血浆血小板活化产物升高:β-TG,PF4,TXB2,GMP-140。②血浆纤维蛋白原含量<1.5g/L或...[详细]
DIC的治疗原则是序贯性,及时性,个体性及动态性。主要治疗包括基础疾病处理及诱因清除,抗凝治疗,凝血因子补充,抗纤溶疗法,溶栓治疗及对症处理等。除对症治疗外,既往多主张其他治疗可酌情同时进行。但近年倾向按序贯方式治疗。即按上述顺序,各种治疗逐项进行,只在前一项治疗未获满意疗效时,再行下一项治疗。 1.基础疾病治疗及诱因消除 如控制感染、治疗肿瘤、处理产科疾病及外伤、纠正休克、缺氧、酸中毒等。 2.抗凝疗法 抗凝治疗迄今仍是终止DIC病理过程,减轻器官功能损伤,重建凝血抗凝平衡的重要措施。 (1)肝素治疗: ①适应证:目前比较一致的认识是:肝素仍是目前DIC抗凝治疗的最重要药物。下列情况的DIC患者,可考虑及早进行肝素治疗:A.不合血型的输血;B.羊水栓塞;C.急性白血病或其他肿瘤;D.感染性流产;E.暴发性紫癜;F.中暑;G.存在高凝状态之基础疾病,如子痫、肾病、肺心病及糖尿病等;H.亚急性或慢性DIC;I.急性DIC的早期;J.其他,如早产儿、腹水自体静脉输液及巨大海绵状血管瘤等。 感染性DIC,重症肝病DIC及新生儿DIC等,肝素使用尚存在争论。 ②禁忌证:①有手术或损伤创面未经良好止血者。②近期有大咯血之结核病或有大量出血之活动性溃疡者。③蛇毒所致之DIC。④晚期患者有多种凝血因子缺乏及明显纤溶亢进等。 ③剂量:既往强调“足量”,如普通肝素(肝素钠)在急性DIC可用药4.5万~9万U/d。近年来,随着对肝素作用认识的深入及制剂的改进,综合性治疗措施的应用等,已趋于小剂量用药。常规或大剂量使用将增加或加重出血并发症。 常规肝素用量:急性DIC,1.5万~4.5万U/d,一般用1.5万U/d左右,每6 h用量不超过7500U。根据病情可连续使用3~5天。 小剂量低相对分子质量肝素[替地肝素(tedelparin,fragmin)]与常规肝素相比,前者生物利用度较高、抗因子Ⅹa作用较强,抗凝血酶作用较弱,对AT-Ⅲ的依赖性较小,较少导致血小板减少,抗凝作用较缓而出血并发症较少,近来得到广泛应用。常用剂量为抗Ⅹa 75~150 U/(kg·d),连用5天。据日本学者观察,以抗Ⅹa 75 U/(kg·d)更为安全有效。 ④用法:既往强调持续静脉滴注,认为可维持稳定而安全的血浆抗凝浓度。近年多主张每6小时1次,皮下注射。 低相对分子质量肝素目前主张每6小时1次,皮下注射,根据病情可连续用药3~5天。 (2)其他抗凝与抗血小板药物: ①丹参或复方丹参注射液:实验及临床研究表明,丹参具有一定的抗凝及抗血小板作用。在DIC治疗中,本药具有疗效肯定、安全、无须严密血液学监护、无明显不良反应等优点。它既可与肝素合用以减少后者之剂量,又可在慢性DIC、疑似病例及缺乏确诊及血液学监测实验条件下作为主要抗凝剂单独使用。剂量:复方丹参注射液20~40ml,加入5%葡萄糖注射液100~200ml内快速静脉滴注,2~4次/d,可连用3~5天。 ②右旋糖酐40葡萄糖注射液:本药有抗血小板、补充血容量及疏通微循环作用,对DIC有一定辅助性治疗价值。常用剂量每次500ml,静脉滴注,每天不超过1000ml,可连用3~5天。 ③双嘧达莫:通过抑制血小板内cAMP之代谢而抑制血小板聚集,有一定抗血栓作用。每次用量200~500mg,置100~200ml输液内静脉滴注,2~3次/d。滴注速度宜缓,以避免局部血管刺激。 ④AT-Ⅲ:近年研究表明,AT-Ⅲ水平的消耗性降低约见于80%的急性DIC患者。这既可降低人体抗凝活性,加速、加重DIC病理过程,也导致肝素治疗效果不佳及出血并发症增多。因此适时适量补充AT-Ⅲ是DIC治疗中的关键措施之一。AT-Ⅲ与肝素合用既可减少肝素用量,增加肝素疗效,又可减少肝素停用后的反弹性血栓形成倾向。每次用量1500~3000U,持续静脉滴注,2~3次/d,根据病情可连用5~7天。暂无AT-Ⅲ制剂时,可用全血或血浆每毫升分别含AT-Ⅲ1U或2U计算。 ⑤[收起]
DIC的治疗原则是序贯性,及时性,个体性及动态性。主要治疗包括基础疾病处理及诱因清除,抗凝治疗,凝血因子补充,抗纤溶疗法,溶栓治疗及对症处理等。除对症治疗外,既往多主张其他治疗可酌情同时进行。但近年倾向按序贯方式治疗。即按上述顺序,各种治疗逐项进行,只在前一项治疗未获满意疗效时,再行下一项治疗。 1.基础疾病治疗及诱因消除 如控制感染、治疗肿瘤、处理产科疾病及外伤、纠正休克、缺氧、酸中毒等。 2.抗凝疗法 抗凝治疗迄今仍是终止DIC病理过程,减轻器官功能损伤,重建凝血抗凝平衡的重要措施。 (1)肝素治疗: ①适应证:目前比较一致的认识是:肝素仍是目前...[详细]
据资料统计,DIC治愈率50%~80%,好转率20%~30%,病死率20%~40%。

 4.纤溶酶激活致凝血-抗凝失调进一步加重 在DIC发病中,起主要作用者除凝血酶之外,另一关键性因素是纤溶酶。近年来学者已将两者并列为DIC发病机制的关键性因素。 DIC过程中纤溶酶的激活因素如下:①活化的因子Ⅻ通过激活纤溶酶原活化物使纤溶酶原转化为纤溶酶。②先期形成的凝血酶具有强大的促纤溶酶形成作用。③许多外源及内源性物质,如某些细菌、病毒、内毒素、尿激酶、胸腔积液、腹水等,可直接促使纤溶酶原转变为纤溶酶。④血管内皮细胞富含组织型纤溶酶原激活剂(t-PA),在损伤或在纤维蛋白刺激下,可释入血流激活纤溶酶原。 纤溶酶在DIC中的作用如下:①降解纤维蛋白,清除血栓,但同时可引起迟发性出血。②多种纤维蛋白降解产物可影响血管通透性及血小板功能,而加重出血。③纤溶酶作为一种蛋白水解酶,可降解多种凝血因子。近年研究证明DIC患者的多种凝血因子减少,除血栓形成过程中的消耗之外,纤溶酶的降解可能也是一种重要原因。 5.微血栓形成 微血栓形成为DIC的基本病理变化,亦为DIC的特征性改变。微血栓的检出率,各家报道差异极大。有人发现感染性疾病导致DIC者可达50%,亦有阳性率高达90%的报道。DIC者微血栓存在部位极为广泛,多见于肺、肾、脑、肝、心、肾上腺、胃肠道及皮肤和黏膜等部位。 DIC微血栓的形态与其形成部位有关,可呈圆形、椭圆形、柱状、条索状、多角形等。在肾小球毛细血管中,则可呈不规则团块或蜂窝状及弧形条状。普通苏木精-伊红染色为一种均质无结构噬红色小体,常充满整个微血管中。血栓较大时,其周围或中央可有脂质溶解后形成的空泡,可有中性粒细胞等居于其中。血栓外周有时可见血小板沉着。血栓如以纤维素等特殊染色,则呈深蓝色均质状或薄雾状小体,形态等与苏木精-伊红染色者相似。电镜研究表明,不同部位微血栓的超微结构可有差异。微血栓在电镜下为边界清楚的团块,但无明确界膜。高倍放大时,可见微血栓由(50~60)nm×10nm的微粒子组成,间或出现22nm横纹状结构的纤维蛋白细束与血栓表面部位结合或覆盖于其上。DIC的肾小球超微结构则显示毛细血管内皮细胞肿胀、增生、管腔内被血小板、纤维蛋白或类纤维蛋白团块所堵塞,间有白细胞散布其间或密集成团。由羊水栓塞所引起的DIC,除微血栓外,在肺毛细血管内尚可发现羊水栓、羊水结晶及羊水内脱落细胞等成分。 DIC微血栓按其组成成分,可分成不同种类:①纤维蛋白血栓,为DIC微血栓的最主要组成部分。近来有人将纤维蛋白血栓分成管腔内无细胞反应型、管腔内伴细胞反应型、内皮外无纤维细胞反应型以及内皮外伴纤维细胞反应型等。②血小板血栓,为DIC早期血栓。主要由血小板聚集而成,由于血小板可以解聚而呈不稳定状态,因而在活性组织检查或尸检中较少发现。③血小板-纤维蛋白血栓,以纤维蛋白为核心,其中或外周有血小板沉积,此种血栓在DIC中亦较常见。④血小板-纤维蛋白-红细胞血栓,亦称混合血栓,多见于较大血管内,除血小板沉积及纤维蛋白凝块形成外,可混有红细胞。红细胞多被纤维蛋白分割包绕而散在,可有溶解而致含铁血黄素沉着,这种血栓在DIC中不多见。伴随微血管栓塞而出现的继发性病理变化有:血栓远端血管痉挛,间质水肿,灶状出血及缺血性坏死。因此,在有微血栓形成的脏器,可出现相应的一过性功能损害,甚至不可逆性的功能衰竭。 6.凝血功能异常 凝血功能异常是DIC最常见的病理生理变化,其检出率可高达90%~100%,其凝血演变过程如下: (1)初发性高凝期:此为DIC的早期改变。实验室检查凝血时间可明显缩短,凝血酶原时间缩短,其他凝血因子水平及活性正常或增高。 (2)消耗性低凝期:在高凝期过程进行的同时,由于高凝期的消耗及纤溶酶对凝血因子的降解,血液凝固性降低。实验室检查可发现凝血时间显著延长。血小板及多种凝血因子水平低下甚至不能测出。此期在DIC中持续时间较长,常构成DIC的主要临床特点及实验室检测异常。 (3)继发性纤溶亢进期:随着血管内血栓形成,大量血小板及凝血因子的消耗及代偿性抗凝增强,凝血过程渐趋减弱,纤溶过程则逐渐加强,且成为DIC病理过程中的主要矛盾,凝血时间显著延长,血块溶解、优球蛋白溶解及纤溶酶原测定等试验显示纤维蛋白溶解亢进。 (4)微循环障碍:微循环障碍为DIC中最常见的病理生理变化之一。其发生直接原因是广泛毛细血管微血栓形成,但还可能与下列因素有关:①DIC广泛出血导致血容量减少。②肺、肝、肠系统等部位广泛性栓塞而致肺动脉及门静脉压力升高,回心血量减少。③激肽系统激活,引起全身性血管扩张,血压下降。④纤维蛋白降解产物引起血管渗透性增高,血浆外渗,血容量进一步下降。⑤纤维蛋白溶解活性增强,纤维蛋白肽A、肽B增加,使血管收缩,致组织灌注进一步减少。⑥心肌内广泛血栓形成,心肌细胞肿胀变性,甚至坏死、断裂,心功能不全,导致搏出量减少。⑦原发病对循环系统的损害作用等。DIC微循环障碍可导致以下不良后果:①加重组织缺血、缺氧,引起代谢性酸中毒及其他代谢产物聚集。②毛细血管括约肌开始反射性痉挛,继之松弛扩张,更多毛细血管开放,血流愈趋缓慢、瘀滞。③组织、器官因栓塞、微循环障碍等原因,血流灌注进一步减少,并呈中毒性损害,造成一过性或持久性功能障碍。④由于毛细血管痉挛,血管内血栓形成及缺氧引起红细胞脆性增加,导致微血管病性溶血的发生。此种现象在毛细血管镜,特别是在扫描电镜下已得到了证实。
4.纤溶酶激活致凝血-抗凝失调进一步加重 在DIC发病中,起主要作用者除凝血酶之外,另一关键性因素是纤溶酶。近年来学者已将两者并列为DIC发病机制的关键性因素。 DIC过程中纤溶酶的激活因素如下:①活化的因子Ⅻ通过激活纤溶酶原活化物使纤溶酶原转化为纤溶酶。②先期形成的凝血酶具有强大的促纤溶酶形成作用。③许多外源及内源性物质,如某些细菌、病毒、内毒素、尿激酶、胸腔积液、腹水等,可直接促使纤溶酶原转变为纤溶酶。④血管内皮细胞富含组织型纤溶酶原激活剂(t-PA),在损伤或在纤维蛋白刺激下,可释入血流激活纤溶酶原。 纤溶酶在DIC中的作用如下:①降解纤维蛋白,清除血栓,但同时可引起迟发性出血。②多种纤维蛋白降解产物可影响血管通透性及血小板功能,而加重出血。③纤溶酶作为一种蛋白水解酶,可降解多种凝血因子。近年研究证明DIC患者的多种凝血因子减少,除血栓形成过程中的消耗之外,纤溶酶的降解可能也是一种重要原因。 5.微血栓形成 微血栓形成为DIC的基本病理变化,亦为DIC的特征性改变。微血栓的检出率,各家报道差异极大。有人发现感染性疾病导致DIC者可达50%,亦有阳性率高达90%的报道。DIC者微血栓存在部位极为广泛,多见于肺、肾、脑、肝、心、肾上腺、胃肠道及皮肤和黏膜等部位。 DIC微血栓的形态与其形成部位有关,可呈圆形、椭圆形、柱状、条索状、多角形等。在肾小球毛细血管中,则可呈不规则团块或蜂窝状及弧形条状。普通苏木精-伊红染色为一种均质无结构噬红色小体,常充满整个微血管中。血栓较大时,其周围或中央可有脂质溶解后形成的空泡,可有中性粒细胞等居于其中。血栓外周有时可见血小板沉着。血栓如以纤维素等特殊染色,则呈深蓝色均质状或薄雾状小体,形态等与苏木精-伊红染色者相似。电镜研究表明,不同部位微血栓的超微结构可有差异。微血栓在电镜下为边界清楚的团块,但无明确界膜。高倍放大时,可见微血栓由(50~60)nm×10nm的微粒子组成,间或出现22nm横纹状结构的纤维蛋白细束与血栓表面部位结合或覆盖于其上。DIC的肾小球超微结构则显示毛细血管内皮细胞肿胀、增生、管腔内被血小板、纤维蛋白或类纤维蛋白团块所堵塞,间有白细胞散布其间或密集成团。由羊水栓塞所引起的DIC,除微血栓外,在肺毛细血管内尚可发现羊水栓、羊水结晶及羊水内脱落细胞等成分。 DIC微血栓按其组成成分,可分成不同种类:①纤维蛋白血栓,为DIC微血栓的最主要组成部分。近来有人将纤维蛋白血栓分成管腔内无细胞反应型、管腔内伴细胞反应型、内皮外无纤维细胞反应型以及内皮外伴纤维细胞反应型等。②血小板血栓,为DIC早期血栓。主要由血小板聚集而成,由于血小板可以解聚而呈不稳定状态,因而在活性组织检查或尸检中较少发现。③血小板-纤维蛋白血栓,以纤维蛋白为核心,其中或外周有血小板沉积,此种血栓在DIC中亦较常见。④血小板-纤维蛋白-红细胞血栓,亦称混合血栓,多见于较大血管内,除血小板沉积及纤维蛋白凝块形成外,可混有红细胞。红细胞多被纤维蛋白分割包绕而散在,可有溶解而致含铁血黄素沉着,这种血栓在DIC中不多见。伴随微血管栓塞而出现的继发性病理变化有:血栓远端血管痉挛,间质水肿,灶状出血及缺血性坏死。因此,在有微血栓形成的脏器,可出现相应的一过性功能损害,甚至不可逆性的功能衰竭。 6.凝血功能异常 凝血功能异常是DIC最常见的病理生理变化,其检出率可高达90%~100%,其凝血演变过程如下: (1)初发性高凝期:此为DIC的早期改变。实验室检查凝血时间可明显缩短,凝血酶原时间缩短,其他凝血因子水平及活性正常或增高。 (2)消耗性低凝期:在高凝期过程进行的同时,由于高凝期的消耗及纤溶酶对凝血因子的降解,血液凝固性降低。实验室检查可发现凝血时间显著延长。血小板及多种凝血因子水平低下甚至不能测出。此期在DIC中持续时间较长,常构成DIC的主要临床特点及实验室检测异常。 (3)继发性纤溶亢进期:随着血管内血栓形成,大量血小板及凝血因子的消耗及代偿性抗凝增强,凝血过程渐趋减弱,纤溶过程则逐渐加强,且成为DIC病理过程中的主要矛盾,凝血时间显著延长,血块溶解、优球蛋白溶解及纤溶酶原测定等试验显示纤维蛋白溶解亢进。 (4)微循环障碍:微循环障碍为DIC中最常见的病理生理变化之一。其发生直接原因是广泛毛细血管微血栓形成,但还可能与下列因素有关:①DIC广泛出血导致血容量减少。②肺、肝、肠系统等部位广泛性栓塞而致肺动脉及门静脉压力升高,回心血量减少。③激肽系统激活,引起全身性血管扩张,血压下降。④纤维蛋白降解产物引起血管渗透性增高,血浆外渗,血容量进一步下降。⑤纤维蛋白溶解活性增强,纤维蛋白肽A、肽B增加,使血管收缩,致组织灌注进一步减少。⑥心肌内广泛血栓形成,心肌细胞肿胀变性,甚至坏死、断裂,心功能不全,导致搏出量减少。⑦原发病对循环系统的损害作用等。DIC微循环障碍可导致以下不良后果:①加重组织缺血、缺氧,引起代谢性酸中毒及其他代谢产物聚集。②毛细血管括约肌开始反射性痉挛,继之松弛扩张,更多毛细血管开放,血流愈趋缓慢、瘀滞。③组织、器官因栓塞、微循环障碍等原因,血流灌注进一步减少,并呈中毒性损害,造成一过性或持久性功能障碍。④由于毛细血管痉挛,血管内血栓形成及缺氧引起红细胞脆性增加,导致微血管病性溶血的发生。此种现象在毛细血管镜,特别是在扫描电镜下已得到了证实。 4.微血管病性溶血 DIC可发现的溶血约见于25%的患者。它所引起的红细胞破坏在DIC诊断上具有极重要的价值。 DIC溶血的发生,主要由以下因素引起:①DIC时毛细血管内广泛血栓形成并有反射性血管痉挛,故管腔高度狭窄,红细胞通过此种狭窄的毛细血管时,受机械性作用而变形、破坏,此为DIC溶血的主要原因(故称微血管病性溶血)。②毛细血管内的纤维蛋白血栓,其表面不甚光滑,存在着许多纤维蛋白丝等附着物。它们可对循环中的红细胞产生拽挂、挤压等机械性损伤,加重红细胞的破坏。③患者的红细胞因缺血、缺氧、代谢毒性产物的作用,致机械脆性增加。 DIC溶血在临床上表现为微血管病性血管内溶血,常有以下特点:①多数缺乏典型急性血管内溶血的症状和特征,如畏寒、发热、腰痛、黄疸等。此可能与溶血程度较轻有关。②部分病例中,不明原因的进行性贫血,或血常规检测时进行性血红蛋白下降,可能是提示DIC溶血反应的惟一证据。③由于微血管病是DIC溶血的主要原因,因此患者红细胞破坏的证据较为明显,如血片中可见大量红细胞碎片和破碎红细胞,以及呈三角形、盔形、棘状等异形红细胞。 5.原发疾病临床表现 除上述主要临床表现外,尚有引起DIC的基础疾病的相应症状及体征,如感染、肿瘤、病理产科、手术及创伤等,均各有其相应的临床表现。 6.其他 DIC的其他临床表现,在文献上尚有:①新生儿DIC主要表现为肢端发冷、精神萎靡、面色青灰或苍白、鼻翼扇动、呼吸不规则、不啼哭或啼声过低、皮肤硬肿、抽搐等。②DIC时皮肤除有出血点、斑块状坏死之外,尚可有暴发性紫癜、指(趾)端发绀及坏死,少数可表现为鼻部坏死。
4.微血管病性溶血 DIC可发现的溶血约见于25%的患者。它所引起的红细胞破坏在DIC诊断上具有极重要的价值。 DIC溶血的发生,主要由以下因素引起:①DIC时毛细血管内广泛血栓形成并有反射性血管痉挛,故管腔高度狭窄,红细胞通过此种狭窄的毛细血管时,受机械性作用而变形、破坏,此为DIC溶血的主要原因(故称微血管病性溶血)。②毛细血管内的纤维蛋白血栓,其表面不甚光滑,存在着许多纤维蛋白丝等附着物。它们可对循环中的红细胞产生拽挂、挤压等机械性损伤,加重红细胞的破坏。③患者的红细胞因缺血、缺氧、代谢毒性产物的作用,致机械脆性增加。 DIC溶血在临床上表现为微血管病性血管内溶血,常有以下特点:①多数缺乏典型急性血管内溶血的症状和特征,如畏寒、发热、腰痛、黄疸等。此可能与溶血程度较轻有关。②部分病例中,不明原因的进行性贫血,或血常规检测时进行性血红蛋白下降,可能是提示DIC溶血反应的惟一证据。③由于微血管病是DIC溶血的主要原因,因此患者红细胞破坏的证据较为明显,如血片中可见大量红细胞碎片和破碎红细胞,以及呈三角形、盔形、棘状等异形红细胞。 5.原发疾病临床表现 除上述主要临床表现外,尚有引起DIC的基础疾病的相应症状及体征,如感染、肿瘤、病理产科、手术及创伤等,均各有其相应的临床表现。 6.其他 DIC的其他临床表现,在文献上尚有:①新生儿DIC主要表现为肢端发冷、精神萎靡、面色青灰或苍白、鼻翼扇动、呼吸不规则、不啼哭或啼声过低、皮肤硬肿、抽搐等。②DIC时皮肤除有出血点、斑块状坏死之外,尚可有暴发性紫癜、指(趾)端发绀及坏死,少数可表现为鼻部坏死。
 3.诊断评析 (1)DIC微血栓栓塞的表现缺乏特异性:在急性DIC时持续时间也较短,往往被临床医师忽视,或不被发现,或被归因于原发病。实际上,微血栓的广泛形成而非出血才是导致组织缺氧及脏器功能不全的最常见原因。如果能在高凝期诊断并治疗DIC,会明显改善预后。DIC出血是机体凝血和造血功能失代偿的表现,主要特点为全身性多部位出血,常无法用原发病解释。认识DIC的临床特点、提高对DIC的警惕性、对存在易于发生DIC的基础疾病的患者常规监测DIC,是早期诊断DIC的关键。 (2)DIC的实验室检查缺乏特异性:不能凭借某一项或某几项试验来确诊DIC。这也是国际上始终未能制定出公认的诊断标准的主要原因。国内制定的诊断标准虽然全面,但通过这几年的运用,有学者认为仍存在不少问题。例如,过于烦琐,有些项目费时、费力,费用高,可操作性差等。国外有学者认为,实际上,如果PT、APTT、纤维蛋白原定量和血小板计数均异常,又有DIC的原发病因和典型的临床表现,诊断基本成立。 在分析化验结果还应注意以下几点:①纤维蛋白原正常不能轻易排除急性DIC的诊断,因为纤维蛋白原为急性相反应蛋白,可因为DIC原发病而增高。当怀疑DIC时,若纤维蛋白原从极高水平骤降至正常低值对诊断有帮助。相反,纤维蛋白原水平极低也并非DIC的特异性诊断指标,譬如许多肝脏疾病的晚期可出现低纤维蛋白原血症。②应强调动态监测血小板,如果短时间内血小板进行性降低,在排除了其他原因之后应想到DIC。③3P试验是用来测定血浆中可溶性纤维蛋白单体复合物,间接反映凝血酶的生成,但可有假阳性,如各种外伤、大手术时。相反,DIC晚期纤维蛋白原极度减少时因几乎没有纤维蛋白单体的进一步生成,3P试验可出现阴性反应。④FDP是纤溶酶降解纤维蛋白和(或)纤维蛋白原的产物,FDP升高提示纤溶酶的生成。但其他血栓性疾病,如深静脉血栓等也可出现FDP的升高。⑤D-二聚体是纤溶酶降解交联的纤维蛋白产生的片段,与FDP相同,其他血栓性疾病也可能出现D-二聚体阳性。 (3)以往曾根据病理生理改变将DIC分为3期:高凝期、消耗性低凝期和纤溶亢进期。这主要取决于凝血酶和纤溶酶活性之间的平衡以及机体的代偿情况等。虽然在临床上往往很难将这3个期截然划分开来,但如能进行初步划分,对治疗方案的选择有一定参考价值。高凝期为DIC的早期,凝血因子相继被激活,血液凝固性增高,大量形成的凝血酶引起微血管内弥散性微血栓形成,导致受累脏器的功能障碍。此时,由于机体的代偿功能良好,血小板和凝血因子水平基本正常,甚至高于正常水平。此期的治疗除了控制原发病外,主要是给以抗凝,而不宜输注凝血因子和血小板,禁用抗纤溶药。消耗性低凝期时由于血小板和凝血因子的大量消耗,超越了机体的代偿能力,或血小板和凝血因子消耗过快,机体来不及代偿,故血小板降低,多种凝血因子缺乏,由此产生凝血功能障碍,临床上大多有出血表现。此期的治疗需在高凝期治疗的基础上,补充凝血因子和(或)血小板。纤溶亢进期时纤溶酶降解纤维蛋白和纤维蛋白原产生大量可干扰止血功能的FDP。另外,纤溶酶还降解因子Ⅴ和因子Ⅷ等使凝血因子进一步降低,出血表现更为明显。此期的治疗需在消耗性低凝期治疗的基础上,酌情给以抗纤溶等治疗。 (4)对于DIC的早期诊断或前DIC的诊断:人们一直在进行不懈研究,但此问题仍未得到解决。其主要原因是前面提到的DIC临床表现和实验室检查缺乏特异性。即使有的检查项目,如凝血酶原碎片1+2(F1+2)和凝血酶-抗凝血酶(TAT)等,可能对诊断有帮助,但由于费用高、不能快速出结果等因素的限制,一时还无法广泛应用于临床。
3.诊断评析 (1)DIC微血栓栓塞的表现缺乏特异性:在急性DIC时持续时间也较短,往往被临床医师忽视,或不被发现,或被归因于原发病。实际上,微血栓的广泛形成而非出血才是导致组织缺氧及脏器功能不全的最常见原因。如果能在高凝期诊断并治疗DIC,会明显改善预后。DIC出血是机体凝血和造血功能失代偿的表现,主要特点为全身性多部位出血,常无法用原发病解释。认识DIC的临床特点、提高对DIC的警惕性、对存在易于发生DIC的基础疾病的患者常规监测DIC,是早期诊断DIC的关键。 (2)DIC的实验室检查缺乏特异性:不能凭借某一项或某几项试验来确诊DIC。这也是国际上始终未能制定出公认的诊断标准的主要原因。国内制定的诊断标准虽然全面,但通过这几年的运用,有学者认为仍存在不少问题。例如,过于烦琐,有些项目费时、费力,费用高,可操作性差等。国外有学者认为,实际上,如果PT、APTT、纤维蛋白原定量和血小板计数均异常,又有DIC的原发病因和典型的临床表现,诊断基本成立。 在分析化验结果还应注意以下几点:①纤维蛋白原正常不能轻易排除急性DIC的诊断,因为纤维蛋白原为急性相反应蛋白,可因为DIC原发病而增高。当怀疑DIC时,若纤维蛋白原从极高水平骤降至正常低值对诊断有帮助。相反,纤维蛋白原水平极低也并非DIC的特异性诊断指标,譬如许多肝脏疾病的晚期可出现低纤维蛋白原血症。②应强调动态监测血小板,如果短时间内血小板进行性降低,在排除了其他原因之后应想到DIC。③3P试验是用来测定血浆中可溶性纤维蛋白单体复合物,间接反映凝血酶的生成,但可有假阳性,如各种外伤、大手术时。相反,DIC晚期纤维蛋白原极度减少时因几乎没有纤维蛋白单体的进一步生成,3P试验可出现阴性反应。④FDP是纤溶酶降解纤维蛋白和(或)纤维蛋白原的产物,FDP升高提示纤溶酶的生成。但其他血栓性疾病,如深静脉血栓等也可出现FDP的升高。⑤D-二聚体是纤溶酶降解交联的纤维蛋白产生的片段,与FDP相同,其他血栓性疾病也可能出现D-二聚体阳性。 (3)以往曾根据病理生理改变将DIC分为3期:高凝期、消耗性低凝期和纤溶亢进期。这主要取决于凝血酶和纤溶酶活性之间的平衡以及机体的代偿情况等。虽然在临床上往往很难将这3个期截然划分开来,但如能进行初步划分,对治疗方案的选择有一定参考价值。高凝期为DIC的早期,凝血因子相继被激活,血液凝固性增高,大量形成的凝血酶引起微血管内弥散性微血栓形成,导致受累脏器的功能障碍。此时,由于机体的代偿功能良好,血小板和凝血因子水平基本正常,甚至高于正常水平。此期的治疗除了控制原发病外,主要是给以抗凝,而不宜输注凝血因子和血小板,禁用抗纤溶药。消耗性低凝期时由于血小板和凝血因子的大量消耗,超越了机体的代偿能力,或血小板和凝血因子消耗过快,机体来不及代偿,故血小板降低,多种凝血因子缺乏,由此产生凝血功能障碍,临床上大多有出血表现。此期的治疗需在高凝期治疗的基础上,补充凝血因子和(或)血小板。纤溶亢进期时纤溶酶降解纤维蛋白和纤维蛋白原产生大量可干扰止血功能的FDP。另外,纤溶酶还降解因子Ⅴ和因子Ⅷ等使凝血因子进一步降低,出血表现更为明显。此期的治疗需在消耗性低凝期治疗的基础上,酌情给以抗纤溶等治疗。 (4)对于DIC的早期诊断或前DIC的诊断:人们一直在进行不懈研究,但此问题仍未得到解决。其主要原因是前面提到的DIC临床表现和实验室检查缺乏特异性。即使有的检查项目,如凝血酶原碎片1+2(F1+2)和凝血酶-抗凝血酶(TAT)等,可能对诊断有帮助,但由于费用高、不能快速出结果等因素的限制,一时还无法广泛应用于临床。 浙公网安备
33010902000463号
浙公网安备
33010902000463号