-
科室:
肝胆外科
-
别名:
Delbet病
原发性硬化性胆管炎
原发性胆道硬变
-
症状:
大三阳
-
发病部位:
暂无
-
多发人群:
多数为30~50岁,男性多于女性
-
相关疾病:
肝胆道疾病
原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)是一种慢性肝胆疾患,其特征为胆道系统弥漫性炎症和纤维化导致胆管变形,并常有多处狭窄。病情呈进行性发展,最终导致胆管阻塞、胆汁性肝硬化和肝衰竭。 Hoffman于1887年首次报道该病,其后陆续有报道。以前多依据开腹手术病理检查得以确诊。虽有多种学说提出,但病因一直不明。自20世纪70年代由于ERCP和PTC的开展和广泛应用,本病的术前诊断及发现率明显提高,发病机制、临床表现、治疗及预后等方面的研究也逐渐深入。
病因迄今未明,研究发现本病患者既无胆系结石、外伤、手术史,也无胆道肿瘤存在,而与自身免疫、遗传、门静脉与胆道的慢性非特异性感染等因素有关。 1.免疫因素 PSC患者同时有许多细胞免疫和体液免疫异常。细胞免疫异常可表现为:体外试验时发现PSC患者胆汁中有某种蛋白能抑制白细胞的迁移,这种蛋白可能与胆管上皮细胞膜有关。提示PSC的发病与胆管抗原的细胞免疫反应有关,但这一现象在原发性胆汁性肝硬化(PBC)和自身免疫性慢活肝时也可见到,缺乏特异性。T细胞浸润是几种器官特异性自身免疫性疾病的特点,大多数PSC肝活检标本可见到汇管区单个核细胞浸润,其中80%是T细胞。外周循环的T细胞总数和不成比例的CD8减少导致CD4/CD8比值增加。免疫组织化学研究发现汇管区周围浸润的单个核细胞T细胞数在PSC患者高于正常人,其中CD4细胞较多。在PSC的胆管上皮细胞可见HLA DR3的异常表达,提示胆管上皮细胞作为自身抗原的可能性,这些改变究竟是由PSC本身引起的,还是胆管梗阻和胆管炎症的继发结果尚未定论。B细胞的数量及百分比增加引起高γ-球蛋白血症,B细胞的增加与组织学病变和血清球蛋白、胆红素水平有关。 体液免疫异常主要表现为:高γ-球蛋白血症,半数患者有IBM增高及部分患者有IgG增高。抗平滑肌抗体和抗核抗体阳性常见。这些自身抗体阳性在PSC致病机制中的作用还不清楚,但可作为免疫异常的标志,研究证实PSC患者血清和胆汁中免疫复合物增多。PSC常合并其他自身免疫性疾病,尤其在欧美大宗报道中合并溃疡性结肠炎最多见。不管是否合并溃疡性结肠炎,还是单纯PSC或溃疡性结肠炎患者,80%可检出细胞核周围抗中性粒细胞胞质抗体(perinuclear antineutrophil cytoplasmic antibody,P-ANCA)。近来的研究发现不仅PSC、溃疡性结肠炎患者P-ANCA阳性率高,而且他们的第一代亲属也有25%~30%的阳性率。因此,P-ANCA可能是免疫异常的一种遗传标志。此外,伴溃疡性结肠炎的PSC患者血清内有抗肠上皮细胞和汇管区上皮的自身抗体。从溃疡性结肠炎患者上皮细胞中分离到一种分子量为4万的蛋白质单克隆抗体,其与PSC患者肝外胆管上皮有交叉反应。以上现象均支持自身免疫在PSC发病中的作用。 2.遗传因素 有报道PSC患者的家族成员可多人患PSC或其他自身免疫学疾病,另外发现PSC患者血清中HLA B8阳性和HLA DR3有较高的效价,明显高于对照组。此外,发现PSC与HLA DR2和HLA DR4也有强的相关性。以上均支持PSC与遗传因素有关。 3.细菌与毒素作用 非特异性的细菌感染与PSC有关。因本病常合并溃疡性结肠炎,这种肠病患者结肠黏膜的防御功能被破坏,肠壁通透性增强,加之肠道菌群失调,肠道细菌容易进入门静脉,引起门静脉菌血症。细菌还可沿胆道逆行,胆管系统受到慢性细菌的刺激,存在着某种遗传和免疫异常的机体就会产生胆管纤维增生而发病。有报道在溃疡性结肠炎行结肠切除术时门静脉血发现有细菌生长;向试验动物门静脉内注入细菌可发生胆管周围炎,均提示PSC与胆管、门静脉的慢性细菌感染有关。除肠内细菌本身外,其代谢物及毒素亦可能成为PSC的致病物质。例如甲酰L-蛋氨酸L-亮氨酸L-酪氨酸为经肠内细菌作用后生成的肽,将其注入大鼠肠管可诱发结肠炎,该物质经肝肠循环在胆汁中出现后,胆管及其周围可引起与PSC相似的组织学改变。提示细菌代谢物及毒素引起PSC的可能性。 4.病毒感染 PSC患者体温和白细胞均不增高或偶有增高,主要为淋巴细胞增高,在胆管慢性炎症反应中,炎性浸润由淋巴细胞、浆细胞、嗜酸细胞组成而无中性白细胞浸润,推测可能为病毒感染引起的损害。还有一些现象如后天性免疫功能不全(AIDS)患者中有巨细胞病毒感染者,其胆管造影与PSC相似;部分PSC者IgM升高,可能与呼吸道肠道病毒(reovirus)感染有关,IgM升高可能为分子复制引起。 5.胆汁酸代谢异常 有学者提出胆汁酸经肠内细菌作用代谢后,产生毒性的胆汁酸,再通过肝肠循环而损伤胆管,引起PSC的学说。如鹅去氧胆酸在肠内细菌作用下经7α脱水氧化生成细胞毒性强的石胆酸,引起胆管损伤。但是PSC或溃疡性结肠炎患者的胆汁及门静脉血中的胆汁酸组成及浓度与正常人相比没有差别,且石胆酸形成后即刻就可转变成无毒的硫酸盐,均不支持此学说。但是肠内胆汁酸代谢生成的异常胆汁酸及其代谢物有很多种,尚待今后进一步研究。 综上所述,从目前的研究来看,无一因素能圆满解释PSC的发病,可能为综合因素共同作用的结果。[收起]
病因迄今未明,研究发现本病患者既无胆系结石、外伤、手术史,也无胆道肿瘤存在,而与自身免疫、遗传、门静脉与胆道的慢性非特异性感染等因素有关。 1.免疫因素 PSC患者同时有许多细胞免疫和体液免疫异常。细胞免疫异常可表现为:体外试验时发现PSC患者胆汁中有某种蛋白能抑制白细胞的迁移,这种蛋白可能与胆管上皮细胞膜有关。提示PSC的发病与胆管抗原的细胞免疫反应有关,但这一现象在原发性胆汁性肝硬化(PBC)和自身免疫性慢活肝时也可见到,缺乏特异性。T细胞浸润是几种器官特异性自身免疫性疾病的特点,大多数PSC肝活检标本可见到汇管区单个核细胞浸润,其中80%是T细胞。外周循环的T细胞总数和不成比...[详细]
PSC病变可累及肝内外胆管,以肝外胆管和肝内较大胆管为主,病变可呈局限性或弥漫性,有时呈节段性受累。肉眼见病变的肝外胆管发硬,呈条索状或形似有血栓形成的静脉,管壁极度增厚,部分胆管可见局限性狭窄和囊性扩张并存。镜下可见管腔明显缩窄甚至闭锁,管壁明显增厚,胆管黏膜看不到病变,自黏膜下到浆膜层可见大量纤维组织沉积、组织间质水肿及淋巴细胞、浆细胞浸润。 PSC的肝活检特征为门静脉区在胆管周围形成洋葱样同心圆形纤维性肥厚,纤维化严重者胆管上皮消失形成纤维芯致使胆管消失。此种改变也见于原发性胆汁性肝硬化,因而PSC的肝脏病理组织变化并不特异,仅靠肝活检诊断本病困难。但是肝活检对PSC的病期及预后的判定有意义。PSC的肝脏组织学分期现多按4期分类方法,Ⅰ期:胆管周围纤维化,炎症限于门静脉区;Ⅱ期:门静脉区及其周围的炎症和纤维化波及肝实质;Ⅲ期:门静脉区之间及门静脉区与中央静脉之间纤维间隔形成;Ⅳ期:胆汁性肝硬化。[收起]
PSC病变可累及肝内外胆管,以肝外胆管和肝内较大胆管为主,病变可呈局限性或弥漫性,有时呈节段性受累。肉眼见病变的肝外胆管发硬,呈条索状或形似有血栓形成的静脉,管壁极度增厚,部分胆管可见局限性狭窄和囊性扩张并存。镜下可见管腔明显缩窄甚至闭锁,管壁明显增厚,胆管黏膜看不到病变,自黏膜下到浆膜层可见大量纤维组织沉积、组织间质水肿及淋巴细胞、浆细胞浸润。 PSC的肝活检特征为门静脉区在胆管周围形成洋葱样同心圆形纤维性肥厚,纤维化严重者胆管上皮消失形成纤维芯致使胆管消失。此种改变也见于原发性胆汁性肝硬化,因而PSC的肝脏病理组织变化并不特异,仅靠肝活检诊断本病困难。但是肝活检对PSC的病期及...[详细]
缓慢起病,早期可无任何症状体征,为无症状期,仅以胆系酶学如AKP、γ-GT等升高为惟一异常发现。此期可持续几年至十几年。患者可伴发溃疡性结肠炎、克罗恩病、腹膜后纤维炎性硬化症、干燥性角膜炎、Reidel甲状腺炎等。此类患者一旦出现原因不明的AKP、γ-GT升高,应考虑存在PSC。 症状常以逐渐出现的瘙痒起病,起初不伴有黄疸,黄疸发生多在6个月~2年之后,表现为慢性间歇性或进行性阻塞性黄疸。可伴右上腹阵发性疼痛、纳差、恶心呕吐等。全身表现以乏力、嗜睡、体重下降、间歇性发热较常见。体征除黄疸外,可见皮肤搔抓伤痕,在疾病后期有些患者的眼睑和伸肌面可见有黄斑瘤或黄瘤。出现色素沉着者不多,见于暴露于日光的部位,肝大最为常见,质硬、压痛不明显。常有脾大,剑突下及右上腹可有压痛,一般无腹膜刺激征,可触及肿大的胆囊,Murphy征常阴性。常见症状和体征出现率见表1。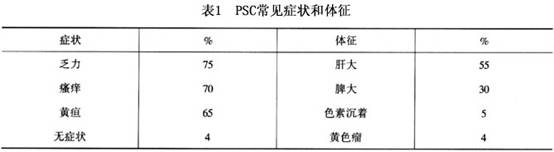 晚期病例常伴有肝硬化门静脉高压的表现;合并有胆系感染时,患者可出现寒战高热、胆绞痛及右上腹局限性腹膜炎体征。10%~20%的PSC并发胆管癌,以肝外胆管癌多见,多中心者也有,不易与PSC自身的胆管狭窄鉴别,因而早期诊断者少。特别是浸润性的肝门部胆管癌鉴别困难。急剧的黄疸加深、体重减轻、生化检查指标恶化、肝内胆管显著扩张或较前扩张加重为并发胆管癌的征象。CEA和CAl9-9升高可视为并发癌的标志,在行ERCP时细胞刷检有助于确诊。[收起]
缓慢起病,早期可无任何症状体征,为无症状期,仅以胆系酶学如AKP、γ-GT等升高为惟一异常发现。此期可持续几年至十几年。患者可伴发溃疡性结肠炎、克罗恩病、腹膜后纤维炎性硬化症、干燥性角膜炎、Reidel甲状腺炎等。此类患者一旦出现原因不明的AKP、γ-GT升高,应考虑存在PSC。 症状常以逐渐出现的瘙痒起病,起初不伴有黄疸,黄疸发生多在6个月~2年之后,表现为慢性间歇性或进行性阻塞性黄疸。可伴右上腹阵发性疼痛、纳差、恶心呕吐等。全身表现以乏力、嗜睡、体重下降、间歇性发热较常见。体征除黄疸外,可见皮肤搔抓伤痕,在疾病后期有些患者的眼睑和伸肌面可见有黄斑瘤或黄瘤。出现色素沉着者不多,见于...[详细]
晚期病例常伴有肝硬化门静脉高压的表现;合并有胆系感染时,患者可出现寒战高热、胆绞痛及右上腹局限性腹膜炎体征。10%~20%的PSC并发胆管癌,以肝外胆管癌多见,多中心者也有,不易与PSC自身的胆管狭窄鉴别,因而早期诊断者少。特别是浸润性的肝门部胆管癌鉴别困难。急剧的黄疸加深、体重减轻、生化检查指标恶化、肝内胆管显著扩张或较前扩张加重为并发胆管癌的征象。CEA和CAl9-9升高可视为并发癌的标志,在行ERCP时细胞刷检有助于确诊。[收起]
缓慢起病,早期可无任何症状体征,为无症状期,仅以胆系酶学如AKP、γ-GT等升高为惟一异常发现。此期可持续几年至十几年。患者可伴发溃疡性结肠炎、克罗恩病、腹膜后纤维炎性硬化症、干燥性角膜炎、Reidel甲状腺炎等。此类患者一旦出现原因不明的AKP、γ-GT升高,应考虑存在PSC。 症状常以逐渐出现的瘙痒起病,起初不伴有黄疸,黄疸发生多在6个月~2年之后,表现为慢性间歇性或进行性阻塞性黄疸。可伴右上腹阵发性疼痛、纳差、恶心呕吐等。全身表现以乏力、嗜睡、体重下降、间歇性发热较常见。体征除黄疸外,可见皮肤搔抓伤痕,在疾病后期有些患者的眼睑和伸肌面可见有黄斑瘤或黄瘤。出现色素沉着者不多,见于...[详细]
1.疾病后期有些患者的眼睑和伸肌面可见有黄斑瘤或黄瘤。 2.常有脾大,剑突下及右上腹可有压痛。 3.晚期病例常伴有肝硬化门静脉高压 4.10%~20%的PSC并发胆管癌,以肝外胆管癌多见,多中心者也有。
1.常规及生化检查 血象嗜酸性细胞增多,淋巴细胞可增多,有时可见异型淋巴细胞。若合并细菌感染白细胞总数及中性粒细胞明显增多,血清结合胆红素升高,AKP及γ-GT升高明显,可为正常的3~4倍。ALT、AST可轻、中度升高。疾病后期可有白蛋白降低和(或)凝血酶原时间延长。总胆固醇升高。铜代谢试验大多异常,可表现为肝铜含量增多,尿铜量增多,血清铜及铜蓝蛋白增加。部分患者血清锌、镁减低。 2.免疫检查 自身抗体检查多数PSC抗结肠抗体、抗中性细胞核抗体、抗中性粒细胞胞质抗体阳性,这些抗体在不伴有PSC的溃疡性结肠炎患者中阳性率也很高。相反抗线粒体抗体(AMA)、抗平滑肌抗体(SMA)和抗核抗体(ANA)一般阴性。血免疫球蛋白升高,以IgM为主。HLA DRW52a阳性。[收起]
1.常规及生化检查 血象嗜酸性细胞增多,淋巴细胞可增多,有时可见异型淋巴细胞。若合并细菌感染白细胞总数及中性粒细胞明显增多,血清结合胆红素升高,AKP及γ-GT升高明显,可为正常的3~4倍。ALT、AST可轻、中度升高。疾病后期可有白蛋白降低和(或)凝血酶原时间延长。总胆固醇升高。铜代谢试验大多异常,可表现为肝铜含量增多,尿铜量增多,血清铜及铜蓝蛋白增加。部分患者血清锌、镁减低。 2.免疫检查 自身抗体检查多数PSC抗结肠抗体、抗中性细胞核抗体、抗中性粒细胞胞质抗体阳性,这些抗体在不伴有PSC的溃疡性结肠炎患者中阳性率也很高。相反抗线粒体抗体(AMA)、抗平滑肌抗体(SMA)和...[详细]
1.内镜逆行胰胆管造影(ERCP) ERCP为PSC最有价值的诊断方法,不但可清晰地显示病变的部位、范围、性质,必要时还可进行内镜下治疗,如狭窄的扩张、放置内支架等。影像表现为胆管狭窄,常侵犯肝外胆管造成狭窄(图1),肝内胆管也常受累,狭窄的范围可呈弥漫性、局限性或节段性,但狭窄段多数小于2cm。病变胆管管壁不规则,肝外胆管管腔内径可仅有2~3mm。肝内胆管分枝减少,纤细僵直,呈“修剪过的枯树枝”状。由于胆管壁及胆管周围炎性纤维化的限制,虽然可见肝外胆管明显狭窄,但一般无肝内胆管明显扩张。若肝内胆管呈节段性狭窄,狭窄间的胆管可有轻微扩张呈“串珠状”。亦有胆管边缘极不规则呈杂乱毛发状(shaggy appearance)者,弥漫性非节段性胆管扩张少见,胆管病变最常见于肝门部大胆管。根据病变胆管的部位可分为肝内型、肝外型及肝内外型3型,肝内外型约占70%。Majoie等将PSC肝内及肝外各自的胆管形态分类如下: (1)肝内:①多处狭窄;胆管直径正常或轻度扩张。②多处狭窄;囊状扩张,分枝减少。③仅中央分枝显影,即使给足够的充盈压力。 (2)肝外:①胆管轮廓轻度不规则,无狭窄。②节段性狭窄。③几乎胆管全长狭窄。④边缘极不规则,憩室样凸出。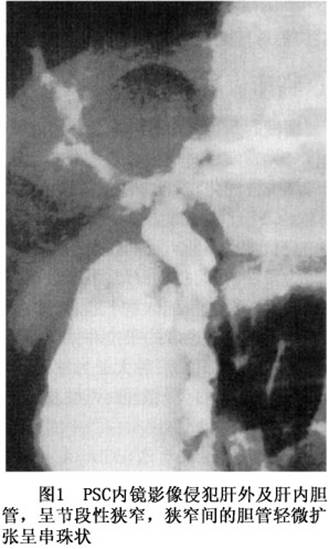 2.磁共振胰胆管造影(MRCP) MRCP是近年开展的一种胰胆管影像学检查新技术。成像原理是,利用磁共振T2的效果,使含水器官显影,从而完成磁共振胰胆管造影。PSC是一种以多发性节段性狭窄为特征的胆管纤维化疾病,MRCP能很好地证实其串珠样表现等特征,影像与ERCP相近。MRCP检查为非侵袭性的,安全、无创伤、不用造影剂、无ERCP后引起败血症等并发症的危险。但是由于无注入造影剂的压力因素影响,MRCP显示的胆管扩张程度略小于ERCP,空间分辨力比ERCP差,对诊断早期或轻型PSC稍有不足。 3.超声波 腹部B超对肝外胆管病变有一定的诊断价值,但缺乏特异性,PSC的超声改变主要表现为胆管壁增厚,其他还可见到管腔狭窄、局灶性扩张等改变。但对以肝内胆管狭窄为主要表现者诊断困难。[收起]
1.内镜逆行胰胆管造影(ERCP) ERCP为PSC最有价值的诊断方法,不但可清晰地显示病变的部位、范围、性质,必要时还可进行内镜下治疗,如狭窄的扩张、放置内支架等。影像表现为胆管狭窄,常侵犯肝外胆管造成狭窄(图1),肝内胆管也常受累,狭窄的范围可呈弥漫性、局限性或节段性,但狭窄段多数小于2cm。病变胆管管壁不规则,肝外胆管管腔内径可仅有2~3mm。肝内胆管分枝减少,纤细僵直,呈“修剪过的枯树枝”状。由于胆管壁及胆管周围炎性纤维化的限制,虽然可见肝外胆管明显狭窄,但一般无肝内胆管明显扩张。若肝内胆管呈节段性狭窄,狭窄间的胆管可有轻微扩张呈“串珠状”。亦有胆管边缘极不规则呈杂乱毛发状(shag...[详细]
2.磁共振胰胆管造影(MRCP) MRCP是近年开展的一种胰胆管影像学检查新技术。成像原理是,利用磁共振T2的效果,使含水器官显影,从而完成磁共振胰胆管造影。PSC是一种以多发性节段性狭窄为特征的胆管纤维化疾病,MRCP能很好地证实其串珠样表现等特征,影像与ERCP相近。MRCP检查为非侵袭性的,安全、无创伤、不用造影剂、无ERCP后引起败血症等并发症的危险。但是由于无注入造影剂的压力因素影响,MRCP显示的胆管扩张程度略小于ERCP,空间分辨力比ERCP差,对诊断早期或轻型PSC稍有不足。 3.超声波 腹部B超对肝外胆管病变有一定的诊断价值,但缺乏特异性,PSC的超声改变主要表现为胆管壁增厚,其他还可见到管腔狭窄、局灶性扩张等改变。但对以肝内胆管狭窄为主要表现者诊断困难。[收起]
1.内镜逆行胰胆管造影(ERCP) ERCP为PSC最有价值的诊断方法,不但可清晰地显示病变的部位、范围、性质,必要时还可进行内镜下治疗,如狭窄的扩张、放置内支架等。影像表现为胆管狭窄,常侵犯肝外胆管造成狭窄(图1),肝内胆管也常受累,狭窄的范围可呈弥漫性、局限性或节段性,但狭窄段多数小于2cm。病变胆管管壁不规则,肝外胆管管腔内径可仅有2~3mm。肝内胆管分枝减少,纤细僵直,呈“修剪过的枯树枝”状。由于胆管壁及胆管周围炎性纤维化的限制,虽然可见肝外胆管明显狭窄,但一般无肝内胆管明显扩张。若肝内胆管呈节段性狭窄,狭窄间的胆管可有轻微扩张呈“串珠状”。亦有胆管边缘极不规则呈杂乱毛发状(shag...[详细]
本病诊断比较困难,临床症状体征、实验室检查无特异性,肝活检的病理改变与原发性胆汁性肝硬化、慢性活动性肝炎不易鉴别。作为诊断依据主要依赖胆管造影所见。现广泛应用于临床的为Wiesner、LaRusso等提出的诊断标准: 1.典型的胆管造影异常,受侵胆管可呈节段性或广泛性。 2.有相应的临床、生化检查和肝组织学所见,但组织学所见不特异。 3.排除标准 胆石(除非与胆汁淤滞有关)、胆道手术(除单纯胆囊切除术)、先天性胆道异常、伴随获得性免疫缺陷综合征胆管病、缺血性狭窄、胆管肿瘤(除非PSC确诊在先)、胆管接触毒物(氟尿苷、甲醛、噻苯达唑等)、同时有其他肝病证据(原发性胆汁性肝硬化、慢性活动性肝炎或药物性胆汁淤积性肝炎)。 对中年男性进行性加重的梗阻性黄疸患者,无胆系结石、肿瘤等疾病存在,肝活检为继发性淤胆或胆汁性肝硬化,应考虑PSC,及早选择ERCP或MRCP,多数患者可获得明确诊断。[收起]
本病诊断比较困难,临床症状体征、实验室检查无特异性,肝活检的病理改变与原发性胆汁性肝硬化、慢性活动性肝炎不易鉴别。作为诊断依据主要依赖胆管造影所见。现广泛应用于临床的为Wiesner、LaRusso等提出的诊断标准: 1.典型的胆管造影异常,受侵胆管可呈节段性或广泛性。 2.有相应的临床、生化检查和肝组织学所见,但组织学所见不特异。 3.排除标准 胆石(除非与胆汁淤滞有关)、胆道手术(除单纯胆囊切除术)、先天性胆道异常、伴随获得性免疫缺陷综合征胆管病、缺血性狭窄、胆管肿瘤(除非PSC确诊在先)、胆管接触毒物(氟尿苷、甲醛、噻苯达唑等)、同时有其他肝病证据(...[详细]
对于PSC至今尚无根治方法,目前最满意的治疗在于成功地改善症状,以及延迟或阻止疾病的恶化,推迟进入肝功能不全和肝移植的病期,防止胆管癌的发生。对于终末期肝硬化上消化道出血等并发症的处理同肝硬化的治疗。 1.一般治疗 患者应注意休息及进食富含蛋白、维生素、高热量、低脂肪饮食。尽量避免应用损伤肝脏的药物,注意保护肝功能。 2.药物治疗 (1)免疫调节治疗: ①糖皮质激素:有利胆、抑制胆管周围炎症的作用,并可抑制纤维化过程,保护肝细胞,减轻炎性坏死,延缓胆管纤维化及肝硬化的进展。常用泼尼松(prednisolone)20~30mg/d,连服15~30天,能使症状改善,血清胆红素及AKP下降。如症状及生化指针改善,可按此剂量再服30天,然后逐渐减量并隔天服药,具体疗程因人而异。但激素的使用不能从根本上改善胆管的病理变化,能否改变病程尚不清楚;由于激素的潜在副作用,一般不主张长期大量应用。 ②甲氨蝶呤(氨甲喋呤):近年文献报道较多且大多疗效肯定。有报道6例有症状患者服药5个月内症状消失,ALT、AST、胆红素等生化指标降低,并有肝组织学的改善。通常剂量每周15mg(每隔12h口服5mg,连续3次),用药至少1年以上。 ③D-青霉胺(D-penicillamine):青霉胺是一种含巯基的氨基酸,能与铜离子结合,驱铜效果明显。多数PSC患者有铜代谢异常。LaRusso等将70例患者分为两组,分别用青霉胺及安慰剂治疗,疗程3年,治疗过程中尽管尿铜排泄量大量增加,肝中铜含量亦下降,但患者生存率及疾病进程并无明显改变,且青霉胺有明显的副作用如白细胞下降、过敏、脱发、腹泻以及蛋白尿等。因此,现多数学者认为青霉胺对本病治疗无实际临床意义。 ④秋水仙碱(colchicine):近年的文献多认为疗效不肯定。对皮质激素治疗失败的患者可试用秋水仙碱治疗,每天1mg口服,或与皮质激素联合应用,有部分患者获得症状缓解或减轻的报道。 (2)利胆药:由于PSC实际上是因胆管狭窄引起的胆汁淤积性疾病,可采用利胆治疗。尽管利胆药不能改变胆管的原发损害,但可促进胆汁分泌,降低胆汁黏稠度,增强胆汁引流,降低胆酸及胆红素浓度,并可改善肝功能,减轻患者瘙痒症状及减少胆管炎的发作。 ①考来烯胺(消胆胺):是一种不吸收碱性聚苯乙烯,作为阴离子交换树脂在肠腔结合胆盐,常为治疗瘙痒的第一线药物。副作用有便秘、脂肪吸收不良及口味不佳。早期有报道使用本药治疗PSC取得一定疗效,近年利胆治疗已被熊去氧胆酸取代。 ②熊去氧胆酸(ursodeoxycholic acid,UDCA):熊去氧胆酸(UDCA)有利胆的作用,能增加胆汁分泌,增加胆汁酸依赖性胆汁流,提高胆汁中胆汁酸和磷脂的含量。此外,磷脂能增加胆固醇的溶解,从而起到溶石的作用。熊去氧胆酸(UDCA)还有直接的保肝作用及肝脏免疫调节作用。文献报道,该药能明显改善PSC患者瘙痒、纳差、嗜睡等症状;能降低血清胆红素50%,并有降低AKP、γ-GT、ALT及AST的作用。但在改变肝实质病理组织学方面的作用不明显,也没有证据表明UDCA能预防并发症的发生和延长患者的生存期。目前熊去氧胆酸(UDCA)是PSC内科治疗的较好药物,可以常规服用。通常剂量为750mg/d,疗程1年。有连续服用8年以上者。该药副作用少,个别发生腹泻,减少剂量后症状可缓解。 (3)抗生素:PSC只在出现继发性胆管炎时,才考虑应用抗生素治疗,宜选用肝脏毒性小且易于从胆道排泄的药物。 (4)其他:因有胆管梗阻,胆汁引流不畅,引起脂肪吸收障碍,多数患者存在维生素吸收障碍,尤以[收起]
对于PSC至今尚无根治方法,目前最满意的治疗在于成功地改善症状,以及延迟或阻止疾病的恶化,推迟进入肝功能不全和肝移植的病期,防止胆管癌的发生。对于终末期肝硬化上消化道出血等并发症的处理同肝硬化的治疗。 1.一般治疗 患者应注意休息及进食富含蛋白、维生素、高热量、低脂肪饮食。尽量避免应用损伤肝脏的药物,注意保护肝功能。 2.药物治疗 (1)免疫调节治疗: ①糖皮质激素:有利胆、抑制胆管周围炎症的作用,并可抑制纤维化过程,保护肝细胞,减轻炎性坏死,延缓胆管纤维化及肝硬化的进展。常用泼尼松(prednisolone)20~30mg/d,连服15~30天,能使...[详细]
伴随影像诊断水平的提高及血生化学检查机会的增加,无症状及较轻症病例得以早期诊断,加之细菌性胆管炎和消化道出血等PSC合并症治疗水平的提高,本病生存期已从20世纪80年代初期的5~7年延长到12~18年。决定预后的因素主要是血胆红素值,组织学的病期,年龄,是否合并炎症性肠病及程度,是否合并胆管癌等。其中组织学Ⅲ期以上的病例,平均生存期约4年;合并胆管癌的病例30%平均生存期不足1年。目前内外科治疗虽然可以缓解症状和延长寿命,但无阻止胆管纤维化的作用,最终发展为胆汁性肝硬化。部分患者转变为胆管癌。死亡原因为复发性细菌性胆管炎、肝功能衰竭、门静脉高压的并发症上消化道出血、肝肾综合征及胆管癌。
原发性硬化性胆管炎病因目前未明,而与自身免疫遗传等因素有关。因此预防尚无有效办法。

 晚期病例常伴有肝硬化门静脉高压的表现;合并有胆系感染时,患者可出现寒战高热、胆绞痛及右上腹局限性腹膜炎体征。10%~20%的PSC并发胆管癌,以肝外胆管癌多见,多中心者也有,不易与PSC自身的胆管狭窄鉴别,因而早期诊断者少。特别是浸润性的肝门部胆管癌鉴别困难。急剧的黄疸加深、体重减轻、生化检查指标恶化、肝内胆管显著扩张或较前扩张加重为并发胆管癌的征象。CEA和CAl9-9升高可视为并发癌的标志,在行ERCP时细胞刷检有助于确诊。
晚期病例常伴有肝硬化门静脉高压的表现;合并有胆系感染时,患者可出现寒战高热、胆绞痛及右上腹局限性腹膜炎体征。10%~20%的PSC并发胆管癌,以肝外胆管癌多见,多中心者也有,不易与PSC自身的胆管狭窄鉴别,因而早期诊断者少。特别是浸润性的肝门部胆管癌鉴别困难。急剧的黄疸加深、体重减轻、生化检查指标恶化、肝内胆管显著扩张或较前扩张加重为并发胆管癌的征象。CEA和CAl9-9升高可视为并发癌的标志,在行ERCP时细胞刷检有助于确诊。 2.磁共振胰胆管造影(MRCP) MRCP是近年开展的一种胰胆管影像学检查新技术。成像原理是,利用磁共振T2的效果,使含水器官显影,从而完成磁共振胰胆管造影。PSC是一种以多发性节段性狭窄为特征的胆管纤维化疾病,MRCP能很好地证实其串珠样表现等特征,影像与ERCP相近。MRCP检查为非侵袭性的,安全、无创伤、不用造影剂、无ERCP后引起败血症等并发症的危险。但是由于无注入造影剂的压力因素影响,MRCP显示的胆管扩张程度略小于ERCP,空间分辨力比ERCP差,对诊断早期或轻型PSC稍有不足。 3.超声波 腹部B超对肝外胆管病变有一定的诊断价值,但缺乏特异性,PSC的超声改变主要表现为胆管壁增厚,其他还可见到管腔狭窄、局灶性扩张等改变。但对以肝内胆管狭窄为主要表现者诊断困难。
2.磁共振胰胆管造影(MRCP) MRCP是近年开展的一种胰胆管影像学检查新技术。成像原理是,利用磁共振T2的效果,使含水器官显影,从而完成磁共振胰胆管造影。PSC是一种以多发性节段性狭窄为特征的胆管纤维化疾病,MRCP能很好地证实其串珠样表现等特征,影像与ERCP相近。MRCP检查为非侵袭性的,安全、无创伤、不用造影剂、无ERCP后引起败血症等并发症的危险。但是由于无注入造影剂的压力因素影响,MRCP显示的胆管扩张程度略小于ERCP,空间分辨力比ERCP差,对诊断早期或轻型PSC稍有不足。 3.超声波 腹部B超对肝外胆管病变有一定的诊断价值,但缺乏特异性,PSC的超声改变主要表现为胆管壁增厚,其他还可见到管腔狭窄、局灶性扩张等改变。但对以肝内胆管狭窄为主要表现者诊断困难。 浙公网安备
33010902000463号
浙公网安备
33010902000463号