-
科室:
小儿内分泌科
-
别名:
diabetes mellitus of childhood
儿童糖尿病
儿童期糖尿病
-
症状:
耳垢多且有甜味
多食
-
发病部位:
暂无
-
多发人群:
5~6岁及10~14岁小儿多发病,5岁以下小儿少见
-
相关疾病:
暂无
糖尿病(diabetes mellitus)是由不同病因与发病机制引起人体内胰岛素缺乏或功能障碍,以致糖、脂肪、蛋白质代谢紊乱,而以高血糖为共同表现的临床综合征。儿童时期的糖尿病是指在15岁以下发生的糖尿病。根据不同的病因,可将儿童时期的糖尿病(diabetes mellitus of childhood)分为:胰岛素依赖型糖尿病(insulin dependent diabetes mellitus,IDDM)、非胰岛素依赖型糖尿病(non-insulin dependent diabetes mellitus,NIDDM)、营养不良性糖尿病、糖耐量损伤及其他类型的糖尿病。 IDDM又称为1型糖尿病(diabetes mellitus typeⅠ),可分为ⅠA及ⅠB 两个亚型。ⅠA型是指由遗传基因、免疫和环境等因素共同参与起病的IDDM;ⅠB型是指家族性自身免疫性疾病中的IDDM。此处主要讨论占儿童时期糖尿病90%以上的胰岛素依赖型糖尿病ⅠA型。[收起]
糖尿病(diabetes mellitus)是由不同病因与发病机制引起人体内胰岛素缺乏或功能障碍,以致糖、脂肪、蛋白质代谢紊乱,而以高血糖为共同表现的临床综合征。儿童时期的糖尿病是指在15岁以下发生的糖尿病。根据不同的病因,可将儿童时期的糖尿病(diabetes mellitus of childhood)分为:胰岛素依赖型糖尿病(insulin dependent diabetes mellitus,IDDM)、非胰岛素依赖型糖尿病(non-insulin dependent diabetes mellitus,NIDDM)、营养不良性糖尿病、糖耐量损伤及其他类型的糖尿病。 IDD...[详细]
根据病因分型如下: 1.自身免疫 (1)环境因素: ①病毒感染:Coxsackie B组病毒、EB病毒、腮腺炎病毒等。 ②牛乳蛋白:过早、过多的摄入牛乳制品,其中酪蛋白作为抗原,触发糖尿病发生。牛乳中牛胰岛素可引起破坏人β细胞功能的免疫反应。 (2)自身抗原:有谷氨酸脱羧酶(GAD)、胰岛素、胰岛抗原、胰岛细胞抗原,产生相应的自身抗体如GAD抗体、胰岛细胞抗体(ICA)、胰岛素自身抗体(IAA)等。 2.1型糖尿病 胰岛β细胞破坏,导致胰岛素绝对缺乏,分2个亚型。 (1)免疫介导性:有HLA-Ⅱ类易感性基因,自身免疫包括GAD65体,IA-ICA512(蛋白质酪氨酸磷酸酶样抗体),2A-2β/Phogrin抗体、IAA、ICA69及多株ICA抗体。亦可伴随其他自身免疫病。儿童青少年多为此型,亦可发生于任何年龄。 (2)特发性:指某些特殊人种中的特殊糖尿病。如美国黑人和南亚印度人1型糖尿病始终无自身抗体。 3.2型糖尿病 以胰岛素抵抗为主伴胰岛素分泌不足,或以胰岛素分泌不足为主伴胰岛素抵抗,此类病人最多,在分类中的定义最不明确。本病也可能为异质性的疾病。明确病因后则归为特殊类型。 4.其他特殊类型糖尿病 有下面几类: (1)β细胞功能的遗传缺陷:①肝细胞核因子-1α(HNF-1 )基因即MODY3基。②肝细胞核因子-4α(HNF-4α)基因即MODY1基因。③肝细胞核因子-1(HNF-1)基因即MODY4基因。④肝细胞核因子-1β(HNF-1β)基因即MODY5基因。⑤葡萄糖激酶(GCK)基因即MODY2基因。⑥Beta A2 NEURODL MODY6基因。⑦线粒体DNA突变:常见的为t RNALeu(UUR)基因t RNA 3243A-G突变,以神经性耳聋最多见。⑧其他。 (2)胰岛素作用的遗传缺陷: ①其共同特点:高血糖高胰岛素血症;糖尿病病情轻重不一,有明显的胰岛素抵抗。常伴有黑棘皮病。 ②本型又分几种:A型胰岛素抵抗;小精灵样综合征;Rabson-Mendenhall综合征;脂肪萎缩性糖尿病(Seip-Lawrence)综合征及其他。 (3)内分泌疾病引起糖尿病。 (4)药物或化学物诱导产生糖尿病:戊烷脒、Vacoi(杀鼠药)、二氮嗪、γ-干扰素、苯托英钠;环孢素、苄噻嗪、β-肾上腺素能激动剂;还有噻嗪和襻类利尿剂及烟酸、抗结核药和口服避孕药。 (5)感染:先天性风疹,巨细胞病毒感染及其他。 (6)免疫介导的罕见类型:僵人综合征。 (7)胰岛素受体抗体病:又称B型胰岛素抵抗。此种受体抗体阻断胰岛素与受体的结合,有明显的高胰岛素血症及严重的胰岛素抵抗和黑棘皮病。常伴有系统性红斑狼疮等自身免疫病。 (8)伴有糖尿病的综合征:此类疾病日渐增多,已经报道的有40多种。ADA 1997年列出10种:3种染色体病为Tumer综合征、Klinefilter综合征和Down综合征。3种运动神经元病为Fried-Reich共济失调、强直性肌营养不良和Huntington舞蹈症;间歇性卟啉病时由红细胞尿卟啉合成酶1基因突变。此外还有Walfrom综合征、Prader-Willi综合征为染色体15q缺陷和Laurence-Moon-Biedl综合征。 5.妊娠糖尿病 为在妊娠期间新诊断的IGT和糖尿病。[收起]
根据病因分型如下: 1.自身免疫 (1)环境因素: ①病毒感染:Coxsackie B组病毒、EB病毒、腮腺炎病毒等。 ②牛乳蛋白:过早、过多的摄入牛乳制品,其中酪蛋白作为抗原,触发糖尿病发生。牛乳中牛胰岛素可引起破坏人β细胞功能的免疫反应。 (2)自身抗原:有谷氨酸脱羧酶(GAD)、胰岛素、胰岛抗原、胰岛细胞抗原,产生相应的自身抗体如GAD抗体、胰岛细胞抗体(ICA)、胰岛素自身抗体(IAA)等。 2.1型糖尿病 胰岛β细胞破坏,导致胰岛素绝对缺乏,分2个亚型。 (1)免疫介导性:有HLA-Ⅱ类易感性基因,自身免疫包括G...[详细]
1.遗传易感 1型糖尿病的发病与HLA-Ⅱ类抗原DR3、DR4有关,单卵双胎先后发生糖尿病的一致性为35%~50%,如同时有HIA-DR3/DR4者发生糖尿病一致性为70%。近年研究表明,发现HIA-DQA链第52位精氨酸、DQB链第57位非门冬氨酸等位基因为1型糖尿病易感性基因;HLA-DQA链第52位非精氨酸,DQB链第57位门冬氨酸等为糖尿病保护基因发生。因此HLA-Ⅱ类分子DR-DQA1-DQB1的结构是影响1型糖尿病的易感性和保护性的主要因素。 此处重点介绍1型糖尿病。 1型糖尿病为一种在遗传基础上由环境因素激发自身免疫性疾病。病因学的研究经过近些年虽然有许多进展,特别在遗传基因和免疫功能方面已有很多的发现,但是仍存在一些问题还未能阐明β细胞破坏的机制。儿童时期的糖尿病绝大多数是由于自身免疫引起的1型糖尿病。其他类型的糖尿病(如MODY)在我国起病于15岁以下儿童者报告少见。由于我国儿童发生肥胖症的明显增多,于15岁以前发生2型糖尿病和IGT的病人近年来时能见到,其中亦有糖尿病家族病史的,是否为MODY尚待研究。其他的有糖尿病的综合征如Wolfram综合征国内亦有报道。 2.病理生理 胰岛素分泌不足或完全缺乏造成葡萄糖利用减少,同时一些反调节激素如胰高糖素、肾上腺素、皮质醇、生长激素分泌增加,促使肝糖原分解和糖原异生增加、脂肪分解和蛋白质分解加速,最终导致血糖升高、血渗透压增高。当血糖浓度超过肾阈值10mmol/L(180mg/dl)时,导致渗透性利尿,临床出现多尿、多饮症状,糖尿产生,严重者可出现电解质失衡和脱水。另外,脂肪分解加速,游离脂肪酸过多,最终酮体产生,形成酮症酸中毒(ketoacidosis)。[收起]
1.遗传易感 1型糖尿病的发病与HLA-Ⅱ类抗原DR3、DR4有关,单卵双胎先后发生糖尿病的一致性为35%~50%,如同时有HIA-DR3/DR4者发生糖尿病一致性为70%。近年研究表明,发现HIA-DQA链第52位精氨酸、DQB链第57位非门冬氨酸等位基因为1型糖尿病易感性基因;HLA-DQA链第52位非精氨酸,DQB链第57位门冬氨酸等为糖尿病保护基因发生。因此HLA-Ⅱ类分子DR-DQA1-DQB1的结构是影响1型糖尿病的易感性和保护性的主要因素。 此处重点介绍1型糖尿病。 1型糖尿病为一种在遗传基础上由环境因素激发自身免疫性疾病。病因学的研究经过近些年虽然有许多进...[详细]
胰岛细胞破坏90%左右可出现糖尿病临床症状。各年龄均可发病,小至出生后3个月,但以5~7岁和10~13岁二组年龄多见,患病率男女无性别差异。 儿童糖尿病起病多数较急骤,几天内可突然表现明显多尿、多饮,每天饮水量和尿量可达几升,胃纳增加但体重下降。年幼者常以遗尿、消瘦引起家长注意。有相当多的病人(约40%),常以急性酮症酸中毒为首发表现,尤其多见于年幼者。表现为胃纳减退、恶心、呕吐、腹痛、关节肌肉疼痛、呼吸深快、呼气中带有酮味,神志萎靡、嗜睡、严重者可出现昏迷。
遗尿、消瘦、呕吐、腹痛,神志萎靡、嗜睡、严重者可出现昏迷。出现脱水、酸中毒,糖尿病酮症酸中毒,并发各种感染等。病程较久糖尿病控制长期不良者有生长落后、身矮、肝脏肿大和智能落后等,称为糖尿病侏儒(Mauriac综合征)。晚期可有白内障、视力障碍及视网膜病变,导致失明。还可发生蛋白尿、高血压为糖尿病肾病,最终导致肾功能衰竭。 1.急性并发症 (1)酮症酸中毒:1型糖尿病病人在发生感染、延误诊断、过食或中断胰岛素治疗时,均可发生酮症酸中毒,年龄越小发生率越高。酮症酸中毒的临床表现如前述。新诊断的1型糖尿病病人以酮症酸中毒起病者,而忽略糖尿病症状时,容易被误诊为肺炎、哮喘或急腹症等应予以鉴别。 (2)低血糖:1型糖尿病病人用胰岛素治疗后发生低血糖多是由于胰岛素超过需要量,或未能在注射胰岛素后按时进餐,或运动前未及时加餐均可发生低血糖。低血糖时出现心悸出汗、饥饿、颤抖、头晕或意识障碍,甚至完全昏迷。低血糖抢救不及时可以引起死亡。低血糖昏迷反复发作可引起脑功能损伤,引起癫痫发作和智力减低。 (3)感染:糖尿病病人随时可以发生任何感染,每当感染后糖尿病迅速恶化。应及时诊断和治疗,严重感染时可发生中毒性休克,如果此时只注意抢救休克而忽视糖尿病的诊断和治疗,可造成严重后果应予警惕。 (4)糖尿病非酮症性高渗性昏迷:儿童1型糖尿病发生高渗性昏迷很少。多数病人是在神经系统疾病的基础上患糖尿病时,可发生高渗性昏迷。非糖尿病病人由于治疗时输入葡萄糖液过多后,发生的高血糖高渗性昏迷时不能诊断为糖尿病高渗性昏迷。有时1型糖尿病病人由于严重脱水引起血浆渗透压增高>310mmol/kgH2O,而血和尿中酮体无明显增高亦无昏迷时,可以诊断为糖尿病高渗状态。 2.中期并发症 1型糖尿病代谢控制不好在病后1~2年内即可出现一些并发症,如注射部位的皮下脂肪萎缩或肥厚影响胰岛素的吸收,还可发生关节活动受限、骨质疏松、白内障、反复发生低血糖和酮症酸中毒等。 3.慢性并发症 微血管并发症在1型糖尿病病后十数年甚至数年后的晚期较常见。视网膜病变严重时可以致盲。糖尿病肾病最终可致肾功能衰竭。如果加强糖尿病的控制,可以延缓或避免微血管并发症的发生和发展。 DCCT(diabetes control and complication trial)的研究证明全年每天平均血糖<8.3mmol/L(150mg/dl),HbAIc<7.5%时可以降低白蛋白尿的年发生率的56%和减少视网膜病变发生的70%。[收起]
遗尿、消瘦、呕吐、腹痛,神志萎靡、嗜睡、严重者可出现昏迷。出现脱水、酸中毒,糖尿病酮症酸中毒,并发各种感染等。病程较久糖尿病控制长期不良者有生长落后、身矮、肝脏肿大和智能落后等,称为糖尿病侏儒(Mauriac综合征)。晚期可有白内障、视力障碍及视网膜病变,导致失明。还可发生蛋白尿、高血压为糖尿病肾病,最终导致肾功能衰竭。 1.急性并发症 (1)酮症酸中毒:1型糖尿病病人在发生感染、延误诊断、过食或中断胰岛素治疗时,均可发生酮症酸中毒,年龄越小发生率越高。酮症酸中毒的临床表现如前述。新诊断的1型糖尿病病人以酮症酸中毒起病者,而忽略糖尿病症状时,容易被误诊为肺炎、哮喘或急腹症等...[详细]
1.血糖测定 血糖测定以静脉血浆(或血清)葡萄糖为标准。1997年美国糖尿病学会(ADA)制定的诊断糖尿病的标准:正常空腹血糖<6.1mmol/L(110mg/dl),空腹血糖6.1~6.9mmol/L为空腹血糖受损;如空腹血糖≥7.0mmol/L,或口服糖耐量试验(OGTT)2h血糖值>11.1mmol/L,即可诊断糖尿病。糖耐量试验不作为临床糖尿病诊断的常规手段。 2.血浆C肽测定 C肽测定可反映内源性胰岛β细胞分泌功能,不受外来胰岛素注射影响。有助于糖尿病的分型。儿童1型糖尿病时C肽值明显低下。 3.糖化血红蛋白(HBAlc) 是代表血糖的真糖部分,可反映近2个月血糖平均浓度,是判断一段时间内血糖控制情况的客观指标,与糖尿病微血管及神经并发症有一定的相关性。正常人HBAlc<6%,HBAlc维持在6%~7%,糖尿病并发症不发生或已发生但不进展,HBAlc>8%,糖尿病并发症显著增加。因此,美国糖尿病学会要求糖尿病的HBAlc控制在<7%,>8%应需采取措施。 4.胰岛细胞抗体(ICA)、胰岛素自身抗体(IAA)、谷氨酸脱羧酶(GAD)抗体测定 糖尿病发病早期,有89.5%病儿ICA,GAD抗体阳性,晚期只有54.3%阳性,GAD比ICA敏感。疾病初期上述抗体大多可呈阳性,随着病程进展,胰岛细胞破坏日益加重,滴度可逐渐下降,待β细胞全部破坏,抗体消失。 5.尿糖(glucose in urine)及酮体测定 尿糖测定只能反映某一特定时间内尿糖排泄情况,且因与肾阈高低、尿糖试纸质量有关,故尿糖阳性仍应测定血糖。酮体包括乙酰乙酸、丙酮、β羟丁酸组成。糖尿病者尿酮体阳性。[收起]
1.血糖测定 血糖测定以静脉血浆(或血清)葡萄糖为标准。1997年美国糖尿病学会(ADA)制定的诊断糖尿病的标准:正常空腹血糖<6.1mmol/L(110mg/dl),空腹血糖6.1~6.9mmol/L为空腹血糖受损;如空腹血糖≥7.0mmol/L,或口服糖耐量试验(OGTT)2h血糖值>11.1mmol/L,即可诊断糖尿病。糖耐量试验不作为临床糖尿病诊断的常规手段。 2.血浆C肽测定 C肽测定可反映内源性胰岛β细胞分泌功能,不受外来胰岛素注射影响。有助于糖尿病的分型。儿童1型糖尿病时C肽值明显低下。 3.糖化血红蛋白(HBAlc) 是代表血糖的真糖部分,可反映近2个...[详细]
根据患儿出现明显多饮,多尿、多食和消瘦,空腹血糖≥7.0mmol/L,口服糖耐量试验2h血糖值>11.1mmol/L,可诊断1型糖尿病。 1999年WHO对糖尿病的诊断标准见表1。
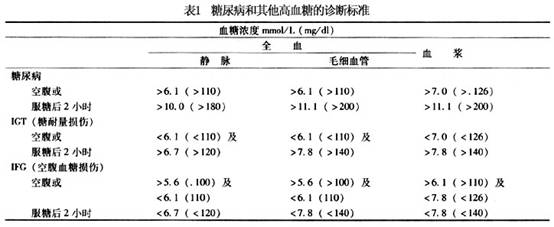
儿童糖尿病治疗目的是:①消除糖尿病症状;②避免或减少酮症酸中毒及低血糖产生;③维持儿童正常生长和性发育;④解除患儿心理障碍;⑤防止中晚期并发症出现。 1.胰岛素替代治疗 儿童1型糖尿病终身需用胰岛素治疗,根据胰岛素作用快慢及持续时间,胰岛素制剂可分长、中、短效。多主张两种胰岛素制剂同时应用和多次注射方法。 (1)短效胰岛素:新诊断者可先给0.5U/kg,如已用胰岛素治疗者,则每天给短效胰岛素0.7U/kg,青春期1.0~1.5U/(kg·d),每天剂量分3次,分别于三餐前30min皮下注射,必要时睡前加用1次低精蛋白胰岛素(中效胰岛素)。数天后可改用短效与低精蛋白胰岛素(中效胰岛素)混合应用,其比例为1∶2或1∶3。一天注射2~3次为宜。 (2)治疗方案:常用胰岛素是早餐前注射短、低精蛋白胰岛素(中效胰岛素) (占总量的2/3)及晚餐前注射短效胰岛素、低精蛋白胰岛素(中效胰岛素)(占总量的1/3)或将晚餐前低精蛋白胰岛素(中效胰岛素)延至睡前注射。根据三餐前、睡前血糖浓度调整胰岛素剂量。如不能用血糖检测,测定每天分段尿糖替代,因尿糖测定往往不能检测出低血糖,故有局限性。 (3)剂量的调整:酮症酸中毒、感染,手术或情绪波动剧烈者,常需加大原剂量的10%~15%;进入糖尿病缓解期或“蜜月期”,胰岛素剂量减少。治疗期间维持餐前血糖水平4.4~6.7mmol/L(80~120mg/dl),餐后血糖水平控制在8.4~10mmol/L(150~180mg/dl)。控制HbAlc<7%。 2.饮食治疗 饮食治疗具体要求: (1)热卡供给:每天总热卡等于1000kcal (年龄-1)×70-100。 (2)饮食成分组成:蛋白质提供热卡占总热卡15%~20%左右,以动物蛋白为主;脂肪占30%左右,以不饱和脂肪酸为主;余下全部热卡由碳水化合物供给。 (3)三餐分配:一般以少量多餐适宜,餐间可加2次点心,避免低血糖发作。多吃纤维素性食物,使糖的吸收缓慢而均匀,从而改善糖的代谢。 3.运动治疗 运动是儿童正常生长和发育所必需的生活内容,运动对于糖尿病儿童更有重要意义。运动使肌肉对胰岛素的敏感性增加,而加速葡萄糖的利用,有利于血糖的控制。运动时肌肉所需能量主要是由脂肪酸代谢提供并动员肌糖原的分解,运动时能量的消耗比安静时增加数倍(7~40倍)。运动能促进心血管的功能,改变血浆中脂蛋白的成分,有利于防止心血管疾病的发生。运动还可使精神饱满,和促进身体健康。但是,糖尿病儿童应在血糖控制良好后(血糖<11.1mmol/L)才能开始运动。运动的种类和激烈的程度因年龄和能力及兴趣不同。 经常参加运动的糖尿病儿童的血糖控制比不参加运动的良好。经研究证明身体好能参加竞争性运动比赛的糖尿病学生在10~30年后并发症的发生率和死亡率均较低。患有视网膜病变时应避免头部的剧烈运动。腿部感觉功能减低时应注意防止碰伤,以徒步运动为好。 4.运动时饮食和胰岛素的调节 糖尿病病人运动时必须做好饮食和胰岛素的调节。运动前减少胰岛素的用量或加餐,并准备好食品以备出现低血糖时食用。在运动前还可改变胰岛素注射的部位,运动时的肢体血流加速胰岛素吸收增快,可将胰岛素注射部位改为腹部。运动时还应保证体内有足量的胰岛素供给需要,防止运动时因胰岛素不足、脂肪分解增加,产生酮体。 糖尿病儿童如能做到每天定时定量的运动,便于血糖的控制和胰岛素的调节。 5.糖尿病的监测 (1)血糖:每天测血糖应成为糖尿病儿童治疗常规的一部分。用血糖仪每天测2~4次血糖,测餐前和餐后2h及睡前的血糖,三餐可以轮换测,血糖是调节胰岛素用量的根据。血糖应控制在餐前4.4~6.7mmol/L(80~120mg/ml),餐后血糖<8.3~10mmol/L(150~180mg/ml)。每天血糖平均应<8.3mmol/L(150mg/ml)为理想,可使微血管并发症的发生可以明显减少。 (2)糖化血红蛋白的测定:糖化血红蛋白(HbAIc)的测定非常重要。HbAIc是血中葡萄糖与血红蛋白非酶性结合产生的,它可以反应红细胞半寿期即60天内的血糖平均水平。正常人为<6.0%,未治疗的糖尿病病人HbAIc 常大于正常的2倍以上。糖尿病病人血糖控制水平平均<8.3mmol/L时:HbAIc <7.6%为良好的控制水平。7.6%~9%为较差,若HbAIc>9%时发生微血管并发症的危险增加。糖化血红蛋白在体内还可进一步的代谢,最后生成糖基化终末产物(AGEs)是发生血管并发症的因素之一。1型糖尿病的控制水平见表2。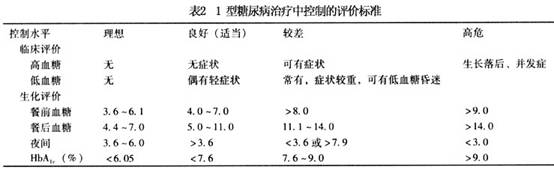 (3)尿微量白蛋白排泄率的测定:用放射免疫方法测尿中尿微量白蛋白排泄率(UAE),常规的测尿蛋白的方法为阴性。正常人UAE<20μg/min(<30mg/24h),糖尿病病人应每年测1~2次UAE。留夜间8~12h或24h的尿,测微量白蛋白,计算每分钟的UAE。若UAE>20μg<200μg/min时应在半年内重复测3次,均在此范围,可以考虑为早期糖尿病肾,应加强血糖控制,UAE可以减少或转为阴性。若持续UAE>200μg/min,则尿蛋白排出量可>0.5g/d,为临床糖尿病肾病。除加强糖尿病的控制外,饮食应减少食物中的蛋白质量(<1g/kg),同时严密观察血压,发生高血压时应积极治疗,使血压控制在正常范围内。[收起]
儿童糖尿病治疗目的是:①消除糖尿病症状;②避免或减少酮症酸中毒及低血糖产生;③维持儿童正常生长和性发育;④解除患儿心理障碍;⑤防止中晚期并发症出现。 1.胰岛素替代治疗 儿童1型糖尿病终身需用胰岛素治疗,根据胰岛素作用快慢及持续时间,胰岛素制剂可分长、中、短效。多主张两种胰岛素制剂同时应用和多次注射方法。 (1)短效胰岛素:新诊断者可先给0.5U/kg,如已用胰岛素治疗者,则每天给短效胰岛素0.7U/kg,青春期1.0~1.5U/(kg·d),每天剂量分3次,分别于三餐前30min皮下注射,必要时睡前加用1次低精蛋白胰岛素(中效胰岛素)。数天后可改用短效与低精蛋白胰岛素(...[详细]
(3)尿微量白蛋白排泄率的测定:用放射免疫方法测尿中尿微量白蛋白排泄率(UAE),常规的测尿蛋白的方法为阴性。正常人UAE<20μg/min(<30mg/24h),糖尿病病人应每年测1~2次UAE。留夜间8~12h或24h的尿,测微量白蛋白,计算每分钟的UAE。若UAE>20μg<200μg/min时应在半年内重复测3次,均在此范围,可以考虑为早期糖尿病肾,应加强血糖控制,UAE可以减少或转为阴性。若持续UAE>200μg/min,则尿蛋白排出量可>0.5g/d,为临床糖尿病肾病。除加强糖尿病的控制外,饮食应减少食物中的蛋白质量(<1g/kg),同时严密观察血压,发生高血压时应积极治疗,使血压控制在正常范围内。[收起]
儿童糖尿病治疗目的是:①消除糖尿病症状;②避免或减少酮症酸中毒及低血糖产生;③维持儿童正常生长和性发育;④解除患儿心理障碍;⑤防止中晚期并发症出现。 1.胰岛素替代治疗 儿童1型糖尿病终身需用胰岛素治疗,根据胰岛素作用快慢及持续时间,胰岛素制剂可分长、中、短效。多主张两种胰岛素制剂同时应用和多次注射方法。 (1)短效胰岛素:新诊断者可先给0.5U/kg,如已用胰岛素治疗者,则每天给短效胰岛素0.7U/kg,青春期1.0~1.5U/(kg·d),每天剂量分3次,分别于三餐前30min皮下注射,必要时睡前加用1次低精蛋白胰岛素(中效胰岛素)。数天后可改用短效与低精蛋白胰岛素(...[详细]
糖尿病的预后取决于血糖控制良好与否。血糖水平长期高于治疗的理想范围者易发生各种慢性并发症,微血管病变是儿童时期糖尿病患儿成年后发展成严重并发症的主要原因。最常见是视网膜病和糖尿病肾病。对糖尿病病程超过5年或青春期发病病程超过2年均需做神经系统检查、尿微量蛋白测定及眼底检查,以早期发现糖尿病微血管并发症。治疗期间也可发生各种中期并发症,如脂肪萎缩和脂肪肥大,与胰岛素制剂纯度有关;骨骼和关节异常,可有骨质疏松;生长障碍和矮小。
1型糖尿病的预防研究开始于20世纪70年代,测ICA的方法用JDF单位标定于1989年瑞典人报告405例新诊1型糖尿病病人与年龄、性别相匹配的321正常人测血中ICA,病人的阳性率为96%(389/405),对照为2.8%(9/321)。随访2年,对照组9人中2人发生糖尿病,其余7人的ICA均<40JDF单位,以后均转为阴性。Joslin-Sacramento从1983年开始对8000名1型糖尿病病人的一级亲属测ICA和(或)IAA,亲属中16/1723(0.9%)阳性,随访2年2人发生糖尿病。后来对于ICA和(或)IAA阳性的人进行标准化的静脉葡萄糖耐量试验(IVGTT),测注射葡萄糖后1min和3min的胰岛素,若胰岛素值小于正常值的5%时,预示将在3年内发生糖尿病。近些年由于GAD的测定又成为预测的指标。 对于发现的高危人群(一级亲属)中。ICA和(或)GAD阳性的人在欧洲和美国已开始大规模的用烟酰胺或胰岛素用于预防性的治疗研究。 德国有一项国际试验,用烟酰胺预防<12岁儿童的1型糖尿病的预防研究称DENIS计划在进行。 由于动物试验发现胰岛素可以延缓糖尿病的发生。美国开展一项称为DPI-I试验研究。对发现有1型糖尿病的高危人后,将其分为2组分别用口服或注射胰岛素进行预防的研究,结果尚需等待。 总之1型糖尿病的预测和预防已经开始研究,由于对1型糖尿病发病机制研究的进展,可能使1型糖尿病的预测和预防的方法将会有更大的进展,期望能取得好的结果。[收起]
1型糖尿病的预防研究开始于20世纪70年代,测ICA的方法用JDF单位标定于1989年瑞典人报告405例新诊1型糖尿病病人与年龄、性别相匹配的321正常人测血中ICA,病人的阳性率为96%(389/405),对照为2.8%(9/321)。随访2年,对照组9人中2人发生糖尿病,其余7人的ICA均<40JDF单位,以后均转为阴性。Joslin-Sacramento从1983年开始对8000名1型糖尿病病人的一级亲属测ICA和(或)IAA,亲属中16/1723(0.9%)阳性,随访2年2人发生糖尿病。后来对于ICA和(或)IAA阳性的人进行标准化的静脉葡萄糖耐量试验(IVGTT),测注射葡萄糖后1m...[详细]

