美国眼科协会临床指南:糖尿病视网膜病变
2016年11月06日 11061人阅读 返回文章列表
疾病分期
2016 版 AAO 指南沿用了此前 DR 的分期,并将其和国际糖尿病性视网膜病变临床分期一并列出(表 1)。

表 1 AAO 糖尿病性视网膜病变分期和国际糖尿病性视网膜病变临床分期
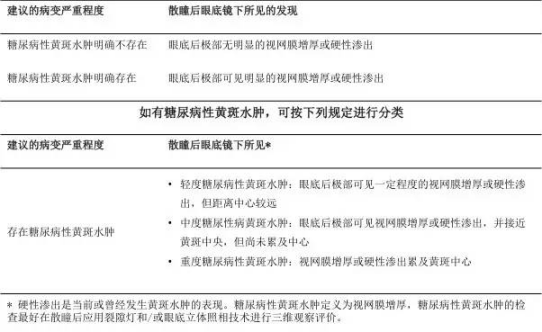
表 2 国际糖尿病性黄斑水肿临床分级
指南强调了糖尿病患者早期发现视网膜病变和定期随访的重要性,并指出眼科医生应向患者说明,即使他们没有任何眼部症状和不适,也应当定期随诊。关于眼科检查的时机和频率,指南给出了如下推荐(表 3):
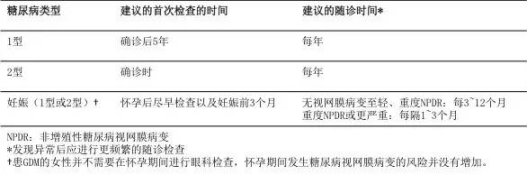
表 3 尚未发生糖尿病性视网膜病变的糖尿病患者进行眼科检查的推荐意见
药物和手术治疗
一、正常或极轻度 NPDR
患者应当接受每年定期复查。一年内 5%~10% 没有视网膜病变的患者会发展为 DR。激光治疗、彩色眼底照相和 FA 并非必需。
二、轻度到中度 NPDR,不伴有黄斑水肿
已经有视网膜微动脉瘤和多发出血灶或硬性渗出的患者应当 6~12 个月接受一次复查。约 16% 的 1 型糖尿病轻度 NPDR 患者会在 4 年内进展到增殖期。对这部分病人,激光治疗和 FA 检查并非必要。彩色眼底照相和 OCT 检查对了解病人的基线状况以方便复诊和患者教育更为有利。
轻度 NPDR 的病人 4 年内发生黄斑水肿的概率约为 12%,中度 NPDR 患者则增加到 23%。即使无临床意义黄斑水肿病人也应在 3~4 年内接受复查,因为发展为 CSME 的风险非常高。
三、轻度到中度 NPDR,伴有 CSME
ETDRS 将 CSME 定义为:距黄斑中央 500μm 及以内有视网膜增厚;距黄斑中央 500μm 及以内有硬性渗出,同时存在邻近视网膜增厚(此条不适用于此前有视网膜增厚,治疗成功后残余的硬性渗出);一处或多处视网膜增厚的面积为 1 个或大于 1 个视盘面积,并且这种病变的任何部分距黄斑中心为 1 个视盘直径之内。
目前,对黄斑水肿也可根据是否累及黄斑中心进行分类,这是由于当黄斑中心被累及时视力丧失的风险和治疗的必要性都将显著增加。
黄斑水肿可通过散瞳后裂隙灯活体显微镜、OCT 和/或立体眼底照相评估。激光治疗之前 FA 检查有助于确定病灶,也可帮助确定毛细血管渗漏和确认黄斑无血管区的病理性扩大。彩色眼底照相可协助记录眼底的情况。OCT 对于发现和观察水肿很有价值。
1. 抗 VEGF 药物:目前,抗 VEGF 药物是累及中心黄斑水肿的首选治疗方式,可联合同时的或者延后的局部激光治疗。相较于 2014 版指南,2016 版指南对抗 VEGF 药物治疗 CSME 方面的内容做了补充,指出贝伐单抗、雷珠单抗和阿柏西普都是对 CSME 的有效治疗手段,然而在患者初始视力较差的情况下(20/50 或更差)阿柏西普对改善视力更为有效。
2. 激光治疗:CSME 的经典治疗方法是激光治疗。在极少数情况下,光凝会导致视网膜下纤维化和脉络膜新生血管,会导致永久性的中心视觉丧失。除了脉络膜新生血管以外,视网膜纤维化最重要的相关因素包括激光治疗前严重的硬性渗出和高血脂。
3. 手术:当存在严重的黄斑部牵拉时,扁平部玻璃体切除能够帮助部分对光凝和抗 VEGF 治疗无效的患者提高视力。然而,玻切术的效果难以通过 RCT 实现评估,因此对其疗效的评价差异很大。
四、严重的 NPDR 和非高危 PDR
根据 ETDRS 得出的数据,严重 NPDR 和非高危 PDR 由于有着相似的临床转归和治疗推荐而被放在一起讨论。一半严重 NPDR 的病人会在 1 年内发展为 PDR,其中 15% 为高危 PDR;对非常严重的 NPDR,1 年内发展为 PDR 的风险为 75%。对这些患者应在 2~4 个月内进行随访。
ETDRS 比较了早期行全视网膜光凝(panretinal photocoagulation, PRP)和延迟 PRP(期间密切随访,在进展为高危 PDR 时立刻行 PRP)的效果,建议对轻度和中度 NPDR 不推荐行 PRP,而在严重 NPDR 发生时,应当考虑 PRP,不应延迟至进展为高危增殖阶段再进行。若暂不进行 PRP,随访应 3~4 个月进行一次,若病人没有定期随访的条件、即将或近期接受白内障手术或处于妊娠状态(增加进展风险),可以考虑早期进行 PRP。
在进展为高危 PDR 之前实行 PRP 对 2 型糖尿病患者尤为重要,PRP 可以降低 50% 发生严重视力损害或接受光凝的风险。对 1 型糖尿病患者,PRP 时机需综合考虑患者的依从性以及另一侧眼对治疗的反应。
五、高危 PDR
以下四点中出现三点即被 DRS(Diabetes Retinopathy Study) 定义为高危 PDR:
①任何部位的新生血管;
②视盘新生血管;
③严重新生血管化:距视乳头 1 个视盘直径范围内有新生血管,其面积大于 1/4~1/3 个视盘面积;其他部位的新生血管面积大于 1/2 个视盘面积;
④玻璃体积血或视网膜前出血。
多数高危 PDR 患者应当在短期内接受 PRP 以防止视力丧失。2016 版指南将对抗 VEGF 药物推荐意见从「可考虑(considered)」变成了「可替代(alternative)」,提出抗 VEGF 药物也许可以代替 PRP 治疗高危 PDR。尽管如此,仍有很多医生认为 PRP 依然是高危 PDR 的首选。由于需要更频繁的复诊,抗 VEGF 药物适用于能够定期随访的病人,其远程并发症仍有待于进一步研究。
出现以下情况或新出现虹膜新生血管时,需考虑重复 PRP 或抗 VEGF 治疗,或行玻璃体手术:
①新生血管未能消退;
②视网膜或虹膜新生血管增多;
③有新的玻璃体积血;
④出现新的新生血管区域。
对于高危 PDR 合并 CSME 的患者,早期就应考虑抗 VEGF 联合 PRP 治疗。部分患者在 PRP 之后出现玻璃体积血,可能是由于此前存在的新生血管牵拉导致,一般可自发吸收,不必再次接受 PRP。
对那些此前从未接受过治疗,又有着屈光介质混浊、活动性新生血管及纤维血管增殖的 PDR 病人,应当考虑扁平部玻璃体切除。早期行玻切的价值随着新生血管形成的危险性而增加。
增殖性视网膜病变晚期应用抗 VEGF 药物的作用还在进一步研究之中。
六、无法接受光凝治疗的高危 PDR
有严重玻璃体积血或视网膜前出血的病人往往无法立即接受光凝治疗,此时应当实行玻璃体切除术。玻切术常在以下情况中应用:威胁黄斑的牵拉性视网膜脱离(尤其是新发的),牵拉性-孔源性视网膜脱离,以及由于玻璃体积血不能接受 PRP 治疗。已经发生虹膜红变的病人应当立即接受玻切和术中眼内光凝。对于这些病人,抗 VEGF 药物的作用还在进一步研究之中。
其他治疗方式
玻璃体内注射糖皮质激素:DRCR.net 一项早期的研究显示,玻璃体内注射曲安奈德(riamcinolone acetonide,TA)在 4 个月时可使视网膜厚度显著减小,但 24 个月时患者的视力不及接受局部/格栅样光凝治疗的患者,副作用(白内障、眼压升高)也更多。糖皮质激素治疗 DME 的效果仍有待于进一步研究。
微脉冲激光:FA 指导的微脉冲激光治疗也开始得到认可。有研究认为,微脉冲激光对黄斑的损伤更小,并得到了具有积极意义的数据。这一研究还没有通过 RCT 和标准的激光治疗效果进行比较。
随访评估
随访包括病史和检查两方面:病史,包括症状、全身状态(是否妊娠、血压、血脂、肾功能等)以及血糖水平(HbA1c) 等;检查,包括以下内容:视力、裂隙灯活体显微镜下检查虹膜、眼压、前房角镜检查(如果怀疑有或发现有虹膜新生血管,或者眼压升高时应检查,检查前应散瞳)、散瞳下对眼底后极部进行立体检查;条件允许时行 OCT,需要时检查周边视网膜和玻璃体。
 浙公网安备
33010902000463号
浙公网安备
33010902000463号