结合基因组测序的膀胱癌精准治疗
2016年08月12日 6186人阅读 返回文章列表
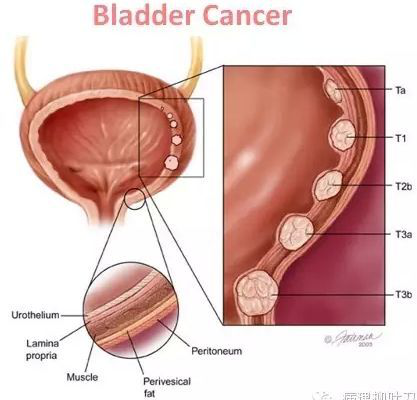
膀胱癌是我国泌尿系统最常见的恶性肿瘤,近年来发病率和病死率均呈逐年增高趋势。膀胱癌的分期主要是根据浸润深度和转移情况的TNM分期,分级主要是根据细胞分化程度等特性,然而对于组织学类型、分期、分级相同的膀胱癌患者,其生存预后却有较大的差异。目前的研究结果表明膀胱癌具有高度的异质性,这种异质性来源于肿瘤细胞中基因组和蛋白质组等的不同改变。阐明膀胱癌发病的分子机制,从而发展针对特定基因改变的治疗方案有重要意义。
一、精准治疗的概念和意义
精准医疗是以个体化医疗为基础、随着基因组测序技术快速进步以及生物信息与大数据科学的交叉应用而发展起来的新型医学概念与医疗模式。其本质是通过基因组、蛋白质组等组学技术和医学前沿技术,对于大样本人群与特定疾病类型进行生物标志物的分析与鉴定、验证与应用,从而精确寻找到疾病的原因和治疗的靶点,并对疾病的不同状态和过程进行精确分类,最终实现对于疾病和特定患者进行个性化精准治疗的目的,提高疾病诊治与预防的效益。

二、膀胱癌的新分子分型
膀胱癌精准治疗的立足点在于对膀胱癌分子发病机制的深入阐明。最近,美国的肿瘤基因组图谱计划(The Cancer Genome Atlas,TCGA)针对131例肌层浸润性膀胱癌患者的DNA、RNA和蛋白质数据进行分析,发现32个基因存在高频突变,这些突变主要集中在细胞周期、染色质调控和激酶信号通路上;此外,还发现多个抑癌基因的缺失,如CDKN2A、RB等,以及癌基因的扩增,如E2F3、SOX4、EGFR、CCND1等。进一步分析基因的mRNA和蛋白表达水平,可以将膀胱癌分为4型,其中I型和II型具有类似乳腺癌管腔样细胞的特性,具有较高的ERBB2表达和雌激素受体2(estrogen receptor 2,ESR2)通路的激活,不同的是I型具有纤维生长因子受体3(fibroblast growth factor receptor 3,FGFR3)的突变和乳头状的组织学表型;III型具有类似乳腺癌基底样细胞(basal)的特性,具有鳞状细胞和干细胞特性的基因表达,如表皮生长因子受体(epidermalgrowth factor receptor,EGFR)以及角蛋白5、6A和14表达增加等;IV型介于II型和III型之间(图1A)。这个基于基因表达的分型为膀胱癌新的分子分型提供了科学依据,不足之处是没有阐明与临床疗效和预后的关系。
Choi等通过对183例膀胱癌的基因表达谱分析,将膀胱癌分为3型,其中管腔样细胞(luminal)型和basal型等同于上述TCGA分型的I型和III型,不同的是将luminal型中p53野生型和其信号通路激活的膀胱癌分为新的一类,称为p53-like型。结合临床预后和疗效分析发现,luminal型的预后最好,并对新辅助化疗敏感;basal型预后最差,而且约60%的患者对新辅助化疗不敏感;p53-like型预后介于上述两者之间,但几乎都对新辅助化疗不敏感(图1B)。上述两种分型的制定是根据mRNA的表达谱聚类分析,根据上述分子标志物,有利于在现有的分级、分期基础上进一步将膀胱癌分型,从而更精确地判断疗效和预后。
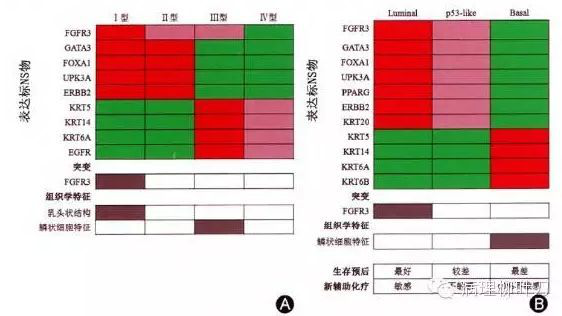
A.肿瘤基因组图谱计划研究将膀胱癌分为4个基因表达型(I~Ⅳ);B.Revi等的研究将膀胱癌分成3型,分别为luminal型、basal型、p53-like型,其中p53-like型是从luminal型中分出的亚型;红色为表达上调,绿色为表达下调,淡红色为表达中等;灰色为阳性,白色为阴性;FGFR3为纤维生长因子受体3;GATA3为GATA结合蛋白3;FOXAl为叉头框蛋白AI;PPARG为过氧化物酶体增殖物激活受体_y;KRT为角蛋白;EGFR为表皮生长因子受体。
三、膀胱癌的疗效判断标志物
肌层浸润性膀胱癌术前行新辅助化疗有助于控制局部病变,使肿瘤降期,降低手术难度和消除微转移灶,提高术后远期生存率。但部分患者因对新辅助化疗不敏感而延误了手术时机,因此预测膀胱癌新辅助化疗敏感性是目前临床上的一个难题。最近的研究发现几类基因的突变或表达异常可以作为膀胱癌化疗敏感性的预测标志物:①DNA损伤修复蛋白,如ERCC1、XRCC1、ERCC2等;②癌基因,如ERBB2、BRAC1等;③化疗耐药基因,如MDR1等。此外,随着影像学的发展,弥散加权MRI的表观弥散系数(apparent diffusion coefficient,ADC)可以作为预测膀胱癌放化疗敏感性的指标。通过检测这些化疗相关标志物,有助于针对性地选择敏感患者行新辅助化疗,而不敏感患者则尽早行根治性膀胱切除术。
针对特定基因改变的靶向治疗在多种肿瘤治疗中取得突出成效,但靶向治疗在膀胱癌中的临床研究仍处于初期,尚未有指南推荐的靶向治疗方案。随着基因组学和蛋白组学的发展,鉴定出来的基因异常改变有望成为潜在的治疗靶点,目前发现有前景的靶点包括:①信号转导通路,如FGFR3、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,P13K)、雷帕霉素靶蛋白(mammalian target of rapamycin,roTOR)、人类表皮生长因子受体2(epidermal growth factor receptor 2,HER2)等;②免疫治疗,如程序性死亡受体-1(programmed death.1,PD-1)、细胞毒T淋巴细胞相关抗原4(cytotoxic T-lymphocyte antigen 4,CTLA4)等;③细胞周期调控,如Aurora kinase A、Polo-like kinase I等。其中,针对PD-1及其配体(PD-1L)的靶向治疗在晚期转移性膀胱癌中取得显著成效,已被美国食品药品监督管理局批准用于膀胱癌治疗。因此,通过检测上述标志物的异常改变,可以为靶向治疗方案的选择提供重要科学依据,从而针对特定基因改变使用相应的治疗方案。2015年发表在EUROPEAN UROLOGYDNA的一篇关于DNA损伤修复基因预测顺铂疗效的文章再一次证明了以二代测序为基础的精准治疗,针对肌肉浸润型膀胱癌患者,ATM、RB1、FANCC这几个基因的突变状态决定了顺铂的疗效。
四、膀胱癌精准治疗展望
膀胱癌精准治疗的发展需要分析和综合分子标志物(基因型)及临床现象(表型)这两方面,从而精准且全面地诊断膀胱癌的特性(亚型)和进展的阶段,实现对于疾病和特定患者进行个性化精准治疗的目的,提高疾病诊治与预防的效益。例如:①对于高危的T1期膀胱癌,如果分子标志物提示对化疗或免疫治疗敏感,应选择相应的腔内化疗或免疫治疗;如果提示不敏感且容易复发转移,尽早行根治性膀胱切除术可能更好。②对于肌层浸润性膀胱癌,目前指南推荐行根治性膀胱切除术,但如果临床表现上是单发、乳头状、直径<3 cm、影像学未发现淋巴结转移,同时病理和分子标志物提示是低度恶性和低转移能力的肿瘤,行膀胱部分切除术可能是一个更好的选择,这有待进一步的临床研究加以证实。③对于晚期转移性膀胱癌,分子标志物的检测有助于选择合适的靶向治疗药物,如果肿瘤PD-L1高表达,可以选择PD-L1的单抗MPDL3280A进行免疫治疗。
基因组学和蛋白组学的发展鉴定出一系列的膀胱癌分子标志物,这为膀胱癌的分子分型以及判断疗效和预后等提供了重要的科学依据和临床指导意义,然而分子标志物仍需进一步地鉴定和发展,如卡介苗治疗敏感性标志物。目前鉴定的标志物绝大多数是通过在白种人中进行的回顾性研究获得,这些标志物在中国人中的临床意义有待通过多中心的回顾性研究来初步评估,并进一步通过前瞻性随机队列研究来验证。将分子标志物与临床的分级、分期,以及影像学、病理学等资料整合后建立一个膀胱癌的新的分子诊断和疗效、预后判断体系,从而更准确且全面地诊断和开展膀胱癌精准治疗,是泌尿外科未来发展的方向和努力实现的目标。
 浙公网安备
33010902000463号
浙公网安备
33010902000463号