疾病指南 | 2010类风湿关节炎诊断及治疗指南
2016年07月05日 3479人阅读
注:本指南由中华医学会风湿病学分会制定。
来源:摘自《中华风湿病学杂志》2010年4月 第14卷 第4期
一、概述
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵蚀性关节炎为主要表现的全身性自身免疫病。本病以女性多发。男女患病比例约1:3。RA可发生于任何年龄,以30~50岁为发病的高峰。我国大陆地区的RA患病率约为0.2%~0.4%。本病表现为以双手和腕关节等小关节受累为主的对称性、持续性多关节炎。病理表现为关节滑膜的慢性炎症、血管翳形成,并出现关节的软骨和骨破坏,最终可导致关节畸形和功能丧失。此外,患者尚可有发热及疲乏等全身表现。血清中可出现类风湿因子(RF)及抗环瓜氨酸多肽(CCP)抗体等多种自身抗体。
二、临床表现
(一)症状和体征
RA的主要临床表现为对称性、持续性关节肿胀和疼痛,常伴有晨僵。受累关节以近端指间关节,掌指关节,腕、肘和足趾关节最为多见;同时,颈椎、颞颌关节、胸锁和肩锁关节也可受累。中、晚期的患者可出现手指的“天鹅颈”及“钮扣花”样畸形,关节强直和掌指关节半脱位,表现掌指关节向尺侧偏斜。除关节症状外,还可出现皮下结节,称为类风湿结节;心、肺和神经系统等受累。
(二)实验室检查
RA患者可有轻至中度贫血,红细胞沉降率(ESR)增快、C反应蛋白(CRP)和血清IgG、IgM、IgA升高,多数患者血清中可出现RF、抗CCP抗体、抗修饰型瓜氨酸化波形蛋白(MCV)抗体、抗P68抗体、抗瓜氨酸化纤维蛋白原(ACF)抗体、抗角蛋白抗体(AKA)或抗核周因子(APF)等多种自身抗体。这些实验室检查对RA的诊断和预后评估有重要意义。
(三)影像学检查
1.X线检查
双手、腕关节以及其他受累关节的X线片对本病的诊断有重要意义。早期X线表现为关节周围软组织肿胀及关节附近骨质疏松;随病情进展可出现关节面破坏、关节间隙狭窄、关节融合或脱位。根据关节破坏程度可将X线改变分为4期(表1)。
表1 RA X线分期

2.磁共振成像(MRI)
MRI在显示关节病变方面优于X线,近年已越来越多地应用到RA的诊断中。MRI可以显示关节炎性反应初期出现的滑膜增厚、骨髓水肿和轻度关节面侵蚀,有益于RA的早期诊断。
3.超声检查
高频超声能清晰显示关节腔、关节滑膜、滑囊、关节腔积液、关节软骨厚度及形态等,彩色多普勒血流显像(CDFI)和彩色多普勒能量图(CDE)能直观地检测关节组织内血流的分布,反映滑膜增生的情况,并具有很高的敏感性。超声检查还可以动态判断关节积液量的多少和距体表的距离,用以指导关节穿刺及治疗。
三、诊断要点
(一)诊断标准
RA的诊断主要依靠临床表现、实验室检查及影像学检查。典型病例按1987年美国风湿病学会(ACR)的分类标准(表2)诊断并不困难,但对于不典型及早期RA易出现误诊或漏诊。对这些患者,除RF和抗CCP抗体等检查外,还可考虑MRI及超声检查,以利于早期诊断。对可疑RA的患者要定期复查和随访。
表2 1987年美国风湿病学会的RA分类标准

2009年ACR和欧洲抗风湿病联盟(EULAR)提出了新的RA分类标准和评分系统,即:至少1个关节肿痛,并有滑膜炎的证据(临床或超声或MRI);同时排除了其他疾病引起的关节炎,并有典型的常规放射学RA骨破坏的改变,可诊断为RA。另外,该标准对关节受累情况、血清学指标、滑膜炎持续时间和急性时相反应物4个部分进行评分,总得分6分以上也可诊断RA(表3)
表3 ACR/EULAR 2009年RA分类标准和评分系统

(二)病情的判断
判断RA活动性的指标包括疲劳的程度、晨僵持续的时间、关节疼痛和肿胀的数目和程度以及炎性指标(如ESR、CRP)等。临床上可采用DAS28等标准判断病情活动程度。此外,RA患者就诊时应对影响其预后的因素进行分析。这些因素包括病程、躯体功能障碍(如HAQ评分)、关节外表现、血清中自身抗体和HLA-DR1/DR4是否阳性,以及早期出现X线提示的骨破坏等。
(三)缓解标准
判断RA的缓解标准有多种。表4列出了ACR提出的RA临床缓解的标准,但有活动性血管炎、心包炎、胸膜炎、肌炎和近期因RA所致的体质量下降或发热,则不能认为临床缓解。
表4 RA 临床缓解标准

(四)鉴别诊断
在RA的诊断中。应注意与骨关节炎、痛风性关节炎、血清阴性脊柱关节病(uSpA)、系统性红斑狼疮(SLE)、干燥综合征(SS)及硬皮病等其他结缔组织病所致的关节炎鉴别。
1.骨关节炎
该病在中老年人多发,主要累及膝、髋等负重关节。活动时关节痛加重,可有关节肿胀和积液。部分患者的远端指间关节出现特征性赫伯登(Heberden)结节,而在近端指关节可出现布夏尔(Bouchard)结节。骨关节炎患者很少出现对称性近端指间关节、腕关节受累,无类风湿结节,晨僵时间短或无晨僵。此外,骨关节炎患者的ESR多为轻度增快,而RF阴性。X线显示关节边缘增生或骨赘形成,晚期可由于软骨破坏出现关节间隙狭窄。
2.痛风性关节炎
该病多见于中年男性,常表现为关节炎反复急性发作。好发部位为第一跖趾关节或跗关节,也可侵犯膝、踝、肘、腕及手关节。本病患者血清自身抗体阴性,而血尿酸水平大多增高。慢性重症者可在关节周围和耳廓等部位出现痛风石。
3.银屑病关节炎
该病以手指或足趾远端关节受累更为常见,发病前或病程中出现银屑病的皮肤或指甲病变,可有关节畸形,但对称性指间关节炎较少,RF阴性。
4.强直性脊柱炎(AS)
本病以青年男性多发,主要侵犯骶髂关节及脊柱,部分患者可出现以膝、踝、髋关节为主的非对称性下肢大关节肿痛。该病常伴有肌腱端炎,HLA-B27阳性而RF阴性。骶髂关节炎及脊柱的X线改变对诊断有重要意义。
5.其他疾病所致的关节炎
SS及SLE等其他风湿病均可有关节受累。但是这些疾病多有相应的临床表现和特征性自身抗体,一般无骨侵蚀。不典型的RA还需要与感染性关节炎、反应性关节炎和风湿热等鉴别。
四、治疗
(一)一般治疗
强调患者教育及整体和规范治疗的理念。适当的休息、理疗、体疗、外用药、正确的关节活动和肌肉锻炼等对于缓解症状、改善关节功能具有重要作用。
(二)药物治疗
侵犯脊柱的PsA,脊柱和骶髂关节病变不对称,可为跳跃式病变,发病常在年龄大的男性。症状较轻,有银屑病皮损和指甲改变;而AS发病年龄较轻,无皮肤、指甲病变,脊柱、骶髂关节病变常呈对称性。
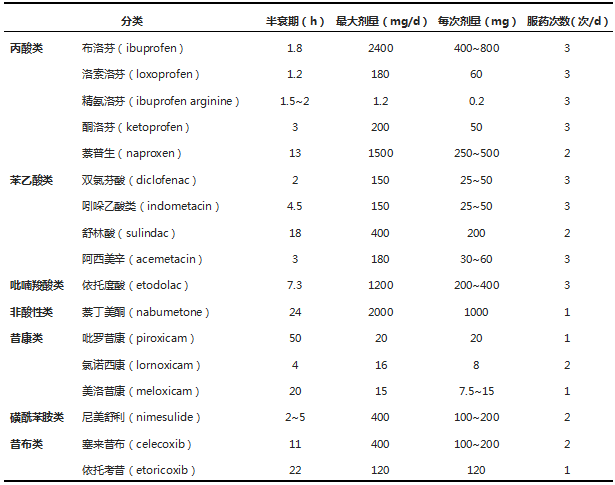
1.非甾体抗炎药(NSAIDs)
这类药物主要通过抑制环氧化酶(COX)活性,减少前列腺素合成而具有抗炎、止痛、退热及减轻关节肿胀的作用,是临床最常用的RA治疗药物(表5)。 NSAIDs对缓解患者的关节肿痛,改善全身症状有重要作用。其主要不良反应包括胃肠道症状、肝和肾功能损害以及可能增加的心血管不良事件。根据现有的循证医学证据和专家共识,NSAIDs使用中应注意以下几点:
①注重NSAIDs的种类、剂量和剂型的个体化;
②尽可能用最低有效量、短疗程;
③一般先选用一种NSAID。应用数日至1周无明显疗效时应加到足量。如仍然无效则再换用另一种制剂,避免同时服用2种或2种以上NSAIDs;
④对有消化性溃疡病史者,宜用选择性COX-2抑制剂或其他NSAID加质子泵抑制剂;
⑤老年人可选用半衰期短或较小剂量的NSAID;
⑥心血管高危人群应谨慎选用NSAID,如需使用,建议选用对乙酰氨基酚或萘普生;
⑦肾功能不全者应慎用NSAIDs;
⑧注意血常规和肝肾功能的定期监测。
NSAIDs的外用制剂(如双氯芬酸二乙胺乳胶剂、辣椒碱膏、酮洛芬凝胶、吡罗昔康贴剂等)以及植物药膏剂等对缓解关节肿痛有一定作用,不良反应较少,应提倡在临床上使用。
表5 治疗RA的主要NSAIDs
2.改善病情抗风湿药(DMARDs)
该类药物较NSAIDs发挥作用慢,大约需1~6个月,故又称慢作用抗风湿药(SAARDs )。这些药物不具备明显的止痛和抗炎作用,但可延缓或控制病情的进展。常用于治疗RA的DMARDs见表6。
表6 治疗RA的主要DMARDs

(1)甲氨蝶呤(methotrexate,MTX):口服、肌肉注射、关节腔内或静脉注射均有效,每周给药1次。必要时可与其他DMARDs联用。常用剂量为7.5~20 mg/周。常见的不良反应有恶心、口腔炎、腹泻、脱发、皮疹及肝损害,少数出现骨髓抑制。偶见肺间质病变。是否引起流产、畸胎和影响生育能力尚无定论。服药期间应适当补充叶酸,定期查血常规和肝功能。
(2)柳氮磺吡啶(salicylazosulfapyriding,SASP):可单用于病程较短及轻症RA,或与其他DMARDs联合治疗病程较长和中度及重症患者。一般服用4~8周后起效。从小剂量逐渐加量有助于减少不良反应。可每次口服250~500mg开始,每日3次,之后渐增至750mg,每日3次。如疗效不明显可增至每日3g。主要不良反应有恶心、呕吐、腹痛、腹泻、皮疹、转氨酶增高,偶有白细胞、血小板减少,对磺胺过敏者慎用。服药期间应定期查血常规和肝功能、肾功能。
(3)来氟米特(leflunomide,LEF):剂量为10~20 mg/d,口服。主要用于病程较长、病情重及有预后不良因素的患者。主要不良反应有腹泻、瘙痒、高血压、肝酶增高、皮疹、脱发和白细胞下降等。因有致畸作用,故孕妇禁服。服药期间应定期查血常规和肝功能。
(4)抗疟药(antimalarials):包括羟氯喹和氯喹两种。可单用于病程较短、病情较轻的患者。对于重症或有预后不良因素者应与其他DMARDs合用。该类药起效缓慢,服用后2~3个月见效。用法为羟氯喹200mg,每天2次。氯喹250mg,每天1次。前者的不良反应较少,但用药前和治疗期间应每年检查1次眼底,以监测该药可能导致的视网膜损害。氯喹的价格便宜,但眼损害和心脏相关的不良反应(如传导阻滞)较羟氯喹常见,应予注意。
(5)青霉胺(D-penicillamine,D-pen):250~500mg/d,口服。一般用于病情较轻的患者,或与其他DMARDs联合应用于重症RA。不良反应有恶心、厌食、皮疹、口腔溃疡、嗅觉减退和肝肾损害等。治疗期间应定期查血、尿常规和肝和肾功能。
(6)金诺芬(auranofin):为口服金制剂,初始剂量为3mg/d,2周后增至6mg/d维持治疗。可用于不同病情程度的RA,对于重症患者应与其他DMARDs联合使用。常见的不良反应有腹泻、瘙痒、口腔炎、肝和肾损伤、白细胞减少,偶见外周神经炎和脑病。应定期查血、尿常规及肝肾功能。
(7)硫唑嘌呤(azathioprine,AZA):常用剂量为1~2mg·kg-1·d-1,一般100~150 mg/d。主要用于病情较重的RA患者。不良反应有恶心、呕吐、脱发,皮疹、肝损害、骨髓抑制,可能对生殖系统有一定损伤,偶有致畸。服药期间应定期查血常规和肝功能。
(8)环孢索A(cyclosporin A,CysA):与其他免疫抑制剂相比,Cys A的主要优点为很少有骨髓抑制,可用于病情较重或病程长及有预后不良因素的RA患者。常用剂量1~3mg·kg-1·d-1。主要不良反应有高血压、肝肾毒性、胃肠道反应、齿龈增生及多毛等。不良反应的严重程度、持续时间与剂量和血药浓度有关。服药期间应查血常规、血肌酐和血压等。
(9)环磷酰胺(cyclophosphamide,CYC):较少用于RA。对于重症患者,在多种药物治疗难以缓解时可酌情试用。主要的不良反应有胃肠道反应、脱发、骨髓抑制、肝损害、出血性膀胱炎、性腺抑制等。
临床上对于RA患者应强调早期应用DMARDs。病情较重、有多关节受累、伴有关节外表现或早期出现关节破坏等预后不良因素者应考虑2种或2种以上DMARDs的联合应用。主要联合用药方法包括MTX、LEF、HCQ及SASP中任意2种或3种联合,亦可考虑环孢素A、青霉胺等与上述药物联合使用。但应根据患者的病情及个体情况选择不同的联合用药方法。
3.生物制剂
可治疗RA的生物制剂主要包括肿瘤坏死因子(TNF)-α拮抗剂、白细胞介素(IL)-1和IL-6拮抗剂、抗CD20单抗以及T细胞共刺激信号抑制剂等。
(1)TNF-α拮抗剂:该类制剂主要包括依那西普(etanercept)、英夫利西单抗(infliximab)和阿达木单抗(adalimumab)。与传统DMARDs相比,TNF-α拮抗剂的主要特点是起效快、抑制骨破坏的作用明显、患者总体耐受性好。依那西普的推荐剂量和用法是25 mg/次,皮下注射,每周2次或50 mg/次,每周1次。英夫利西单抗治疗RA的推荐剂量为3mg·kg-1·次-1,第0、2、6周各1次,之后每4~8周1次。阿达木单抗治疗RA的剂量是40mg/次,皮下注射,每2周1次。这类制剂可有注射部位反应或输液反应,可能有增加感染和肿瘤的风险,偶有药物诱导的狼疮样综合征以及脱髓鞘病变等。用药前应进行结核筛查,除外活动性感染和肿瘤。
(2)IL-6拮抗剂(tocilizumab):主要用于中重度RA,对TNF-α拮抗剂反应欠佳的患者可能有效。推荐的用法是4~10mg/kg,静脉输注,每4周给药1次。常见的不良反应是感染、胃肠道症状、皮疹和头痛等。
(3)IL-1拮抗剂:阿那白滞素(anakinra)是目前唯一被批准用于治疗RA的IL-1拮抗剂。推荐剂量为100mg/d,皮下注射。其主要不良反应是与剂量相关的注射部位反应及可能增加感染概率等。
(4)抗CD20单抗:利妥昔单抗(rituxiamb)的推荐剂量和用法是:第一疗程可先予静脉输注500~1000mg,2周后重复1次。根据病情可在6~12个月后接受第2个疗程。每次注射利妥昔单抗之前的半小时内先静脉给予适量甲泼尼龙。利妥昔单抗主要用于TNF-α拮抗剂疗效欠佳的活动性RA。常见的不良反应是输液反应,静脉给予糖皮质激素可将输液反应的发生率和严重度降低。其他不良反应包括高血压、皮疹、瘙痒、发热、恶心、关节痛等,可能增加感染概率。
(5)CTLA4-Ig:阿巴西普(abatacept)用于治疗病情较重或TNF-α拮抗剂反应欠佳的患者。根据患者体质量不同,推荐剂量分别是:500mg(
4.糖皮质激素
糖皮质激素(简称激素)能迅速改善关节肿痛和全身症状。在重症RA伴有心、肺或神经系统等受累的患者,可给予短效激素,其剂量依病情严重程度而定。针对关节病变,如需使用,通常为小剂量激素(泼尼松≤7.5 mg/d)仅适用于少数RA患者。激素可用于以下几种情况:①伴有血管炎等关节外表现的重症RA。②不能耐受NSAIDs的RA患者作为“桥梁”治疗。③其他治疗方法效果不佳的RA患者。④伴局部激素治疗指征(如关节腔内注射)。激素治疗RA的原则是小剂量、短疗程。使用激素必须同时应用DMARDs。在激素治疗过程中,应补充钙剂和维生素D。
关节腔注射激素有利于减轻关节炎症状,但过频的关节腔穿刺可能增加感染风险,并可发生类固醇晶体性关节炎。
5.植物药制剂
(1)雷公藤:对缓解关节肿痛有效,是否减缓关节破坏尚乏研究。一般给予雷公藤多苷30~60 mg/d,分3次饭后服用。主要不良反应是性腺抑制,导致男性不育和女性闭经。一般不用于生育期患者。其他不良反应包括皮疹、色素沉着、指甲变软、脱发、头痛、纳差、恶心、呕吐、腹痛、腹泻、骨髓抑制、肝酶升高和血肌酐升高等。
(2)白芍总苷:常用剂量为600mg,每日2~3次。对减轻关节肿痛有效。其不良反应较少,主要有腹痛、腹泻、纳差等。
(3)青藤碱:每次20~60mg,饭前口服,每日3次,可减轻关节肿痛。主要不良反应有皮肤瘙痒、皮疹和白细胞减少等。
(三)外科治疗
RA患者经过积极内科正规治疗,病情仍不能控制,为纠正畸形,改善生活质量可考虑手术治疗。但手术并不能根治RA,故术后仍需药物治疗。常用的手术主要有滑膜切除术、人工关节置换术、关节融合术以及软组织修复术。
1.滑膜切除术
对于经积极正规的内科治疗仍有明显关节肿胀及滑膜增厚,X线显示关节间隙未消失或无明显狭窄者,为防止关节软骨进一步破坏可考虑滑膜切除术,但术后仍需正规的内科治疗。
2.人工关节置换术
对于关节畸形明显影响功能,经内科治疗无效,X线显示关节间隙消失或明显狭窄者,可考虑人工关节置换术。该手术可改善患者的日常生活能力,但术前、术后均应有规范的药物治疗以避免复发。
3.关节融合术
随着人工关节置换术的成功应用,近年来,关节融合术已很少使用,但对于晚期关节炎患者、关节破坏严重、关节不稳者可行关节融合术。此外,关节融合术还可作为关节置换术失败的挽救手术。
4.软组织手术
RA患者除关节畸形外,关节囊和周围的肌肉、肌腱的萎缩也是造成关节畸形的原因。因此,可通过关节囊剥离术、关节囊切开术、肌腱松解或延长术等改善关节功能。腕管综合征可采用腕横韧带切开减压术。肩、髋关节等处的滑囊炎,如经保守治疗无效,需手术切除。胭窝囊肿偶需手术治疗。类风湿结节较大,有疼痛症状,影响生活时可考虑手术切除。
(四)其他治疗
除前述的治疗方法外。对于少数经规范用药疗效欠佳,血清中有高滴度自身抗体、免疫球蛋白明显增高者可考虑免疫净化,如血浆置换或免疫吸附等治疗。但临床上应强调严格掌握适应证以及联用DMARDs等治疗原则。
此外。自体干细胞移植、T细胞疫苗以及间充质干细胞治疗对RA的缓解可能有效,但仅适用于少数患者,仍需进一步的临床研究。
五、预后
RA患者的预后与病程长短、病情程度及治疗有关。对具有多关节受累、关节外表现重、血清中有高滴度自身抗体和HLA-DR1/DR4阳性,以及早期出现骨破坏的患者应给予积极的治疗。大多数RA患者经规范内科治疗可以临床缓解。
 浙公网安备
33010902000463号
浙公网安备
33010902000463号